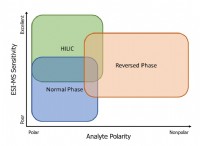
1。水の極性
水分子(H₂O)は極性です。これは、彼らがわずかに正の端(水素原子の近く)とわずかに負の端(酸素原子の近く)を持っていることを意味します。この極性は、イオン化合物を溶解するために重要です。
2。魅力と解離
* アトラクション: 水分子の正の端は、イオン化合物の負に帯電したイオン(陰イオン)を引き付けます。同様に、水分子の負の端は、正の帯電イオン(陽イオン)を引き付けます。
* 解離: この引力は、イオン結晶格子にイオンを一緒に保持する静電力を弱めます。 水分子は効果的に囲み、イオンを引き離し、互いに分離します。
3。水分補給
分離すると、イオンは水分子の球体に囲まれ、水分補給シェルを形成します。この水分子の殻は、イオンを効果的に分離し、それらが固体結晶構造に再結合するのを防ぎます。
例:塩化ナトリウム(NaCl)
* naClクリスタル: 塩化ナトリウムは、陽性に帯電したナトリウムイオン(Na⁺)と、静電力によって一緒に保持されている負に帯電した塩化物イオン(Cl⁻)を含む固体結晶格子として存在します。
* 水に溶解する: NaClを水に加えると、極水分子はNa⁺イオンとcl⁻イオンを囲みます。水分子の正の末端は塩化物イオン(Cl⁻)を引き付け、水分子の負の末端はナトリウムイオン(Na⁺)を引き付けます。
* 水分補給: 水分子は、イオンを効果的に「引っ張って」、それらを囲み、水分補給シェルを形成します。水和イオン(Na⁺(AQ)およびCl⁻(AQ))は、溶液中に独立して自由に移動できるようになりました。
キーポイント:
* 溶媒和: 溶媒分子(水など)を使用した周囲のイオンのプロセスは、溶媒和と呼ばれます。
* 溶解度: イオン化合物が水に溶解する程度は、結晶格子のイオン自体間の誘引と比較して、イオンと水分子間の誘引の強度に依存します。
* 電解質: 水に溶解して遊離イオンを生成するイオン化合物は、電解質と呼ばれます。遊離イオンは電流を運ぶことができるため、彼らは電気を伝達します。