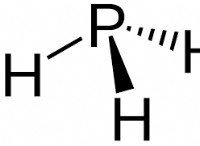
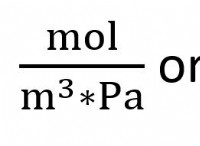1。水素結合:
* 水: 水分子は強い水素結合を示します。高強性酸素原子は、水素原子から電子を引き付け、酸素に部分的な負電荷と水素原子の部分的な正電荷を生成します。この極性により、水分子間の強い分子間魅力が可能になり、水素結合が形成されます。
* 硫化水素: 硫化水素も極性結合結合を持っていますが、硫黄は酸素よりも電気陰性が少ないです。結果として生じる双極子モーメントは弱く、H₂S分子間の水素結合は水よりもはるかに弱いです。
2。分子サイズと形状:
* 水: 水は、酸素原子の2つの孤立ペアのため、曲がった分子形状です。この形状により、より効率的な水素結合が可能になります。
* 硫化水素: 硫化水素は線形形状で、これが形成できる水素結合の数を制限します。
3。ファンデルワールス力:
* 水: 水素結合よりも弱いものの、ファンデルワールスの力は、水分子を一緒に保持する上で役割を果たします。
* 硫化水素: 硫化水素は水よりも分子サイズが大きいため、ファンデルワールスの力がわずかに強くなります。しかし、これらの力は、水に存在する水素結合よりもはるかに弱いです。
要約:
極性と曲がった形状によって促進される水中の強い水素結合は、硫化水素に存在する弱い力と比較して、克服するためのエネルギーが大幅に増加する必要があります。これにより、水がはるかに高い沸点があります。