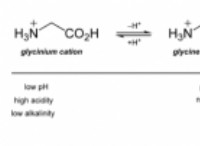
その理由は次のとおりです。
* 硫酸(h₂so₄) 強酸です。つまり、溶液中に水素イオン(H⁺)を容易に寄付します。
* 水素イオン(H⁺) +1充電してください。
* 硫酸イオン(so₄²⁻) -2充電してください。
* 分子自体は中性です なぜなら、水素イオンからの2つの正電荷は、硫酸イオンからの2つの負電荷をキャンセルするからです。
したがって、単独で考慮される単一の硫酸分子には、全体的な電荷はありません。
しかし、水に溶解すると、硫酸はイオンに解離し、水素イオンの存在により正電荷の溶液をもたらします。