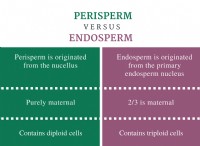
1。反応の理解:
* 重炭酸ナトリウム(Nahco₃)を硫酸(H₂SO₄)を含む:
2nahco₃ +h₂so₄→na₂so₄ + 2h₂o + 2co₂
* 炭酸ナトリウム(ナトコ₃)を硫酸(h₂so₄)とともに:
na₂co₃ +h₂so₄→na₂so₄ +h₂o +co₂
2。仮定:
*nahco₃とna₂co₃の混合物があると仮定しており、生成されたco₂の総量を知りたいと思っています。
* 100グラムの混合物の割合の組成を知る必要があります。 たとえば、75グラムがnahco₃、25グラムの場合はNa₂co₃です。
3。計算:
ステップ1:各反応物のモルを計算します
* nahco₃:
*nahco₃のモル質量=84 g/mol
*nahco₃のモル=(nahco₃の質量) /(nahco₃のモル質量)
*(例:75グラムの場合nahco₃:75 g / 84 g / mol =0.893モル)
* na₂co₃:
*na₂co₃=106 g/molのモル質量
*na₂co₃=(na₂co₃の質量) /(na₂co₃のモル質量)のモル
*(例:25グラムの場合、Na₂co₃:25 g / 106 g / mol =0.236モル)
ステップ2:各反応物から生成されたco₂のモルを決定
* nahco₃から:
*co₂=(nahco₃のモル) *(2モルCo₂ / 2モルnahco₃)=nahco₃のモル
*(例:0.893MolesCo₂)
* na₂co₃から:
*co₂=(na₂co₃のモル) *(1モルCo₂ / 1モルナ₂co₃)=na₂co₃のモル
*(例:0.236MolesCo₂)
ステップ3:生成されたco₂の総モルを計算します
*co₂=nahco₃ +co₂からのco₂の総モル=na₂co₃からのco₂のモル
*(例:0.893モル + 0.236モル=1.129モルCO₂)
ステップ4:理想的なガス法を使用してCo₂の量を計算
* 理想的なガス法: pv =nrt
* p =圧力(通常1気圧と想定)
* v =ボリューム(私たちが解決しているもの)
* n =co₂のモル(例から1.129モル)
* r =理想的なガス定数(0.0821 L・atm/mol・k)
* t =温度(ケルビンでは、温度を指定する必要があります)
* v:を解くために再配置します
* v =(nrt) / p
*(例:v =(1.129 mol * 0.0821 L・mol・k * 298 k) / 1 atm =27.7 l)
重要なメモ:
*正しい量を取得するには、100グラムの混合物の特定の割合の組成(nahco₃とna₂coが存在するものの量)が必要です。
*Co₂の体積は温度に大きく依存しています。ガス量を測定している温度を知っていることを確認してください。
混合物の組成の割合がある場合はお知らせください。