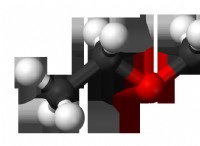
1。分子間力(IMFS):
* 溶媒溶媒相互作用: 溶媒内の分子は、IMFによって一緒に保持されます。これらは弱い(ロンドン分散力のような)または強い(水素結合など)。
* 溶質 - ソリュート相互作用: 同様に、溶質内の分子もIMFを経験します。
* 溶媒 - ソリュート相互作用: 溶媒と溶質が接触すると、IMFSを介して相互作用します。
2。溶解度:
* "like like dislols like": 溶媒と溶質の間のIMFSが強度が似ている場合、溶媒は溶質を最適に溶解します。
* 例: 水(非常に極性、強い水素結合)は、両方とも強い相互作用があるため、テーブル塩(イオン、強い静電アトラクション)を溶解します。
* 例: オイル(非極性、弱いロンドン分散力)は、相互作用が非常に異なるため、塩を溶解しません。
* 絆の破壊と形成: 溶解するには、溶質分子と溶媒分子間のIMFS間のIMFを破壊し、溶媒分子と溶質分子の間に新しいIMFを形成することが含まれます。
*新しい溶媒溶媒溶媒相互作用が元の溶媒溶媒と溶質 - ソリュートの相互作用よりも強い場合、プロセスはエネルギー的に好ましく、溶質が溶解します。
3。キーポイント:
* 極性溶媒: 水(h₂o)、エタノール(c₂h₅oh)、アセトン(ch₃coch₃)などの溶媒は、極性溶質とイオン化合物の溶解に優れています。
* 非極性溶媒: ヘキサン(C₆H₁₄)、ジエチルエーテル(C₄H₁₀O)、トルエン(C₇H₈)などの溶媒は、非極性溶質の溶解に優れています。
* 溶解度に影響する要因: 温度、圧力、および他の溶質の存在も溶解度に影響を与える可能性があります。
要約: 溶媒分子と溶質分子間のIMFの強度は、物質を溶解する溶媒の能力を決定します。溶媒と溶質の間の引力が強いほど、物質が溶解する可能性が高くなります。これは、多くの場合、「ように溶けるような」という原則によって要約されます。