主な違い - 浸透圧と浸透圧
浸透圧は液体に関する用語です。浸透を避けるために必要な圧力です。言い換えれば、浸透圧は、浸透によって溶質を溶解した溶液に純粋な溶液が入るのを避けるために加えなければならない圧力です。浸透圧と浸透圧は浸透圧に関連しています。それらは、オスモルの観点から浸透圧を測定するために使用されます。浸透圧とは、浸透圧に寄与する化合物のモル数です。浸透圧と浸透圧の主な違いは、浸透圧は溶液の体積を考慮した尺度であるのに対し、浸透圧は溶液の質量を考慮して測定されることです。
対象となる主な分野
1.浸透圧とは
– 定義、例による説明
2.浸透圧とは
– 定義、例による説明
3.浸透圧と浸透圧の関係
– 方程式の説明
4.浸透圧と浸透圧の違いは何ですか
– 主な違いの比較
重要な用語:浸透圧、浸透圧、オスモル、浸透圧 
浸透圧とは
オスモル濃度は、検討中の溶液 1 リットルあたりのオスモル数です。つまり、浸透活性を示す溶液の濃度を表す用語です。これは、浸透圧が浸透圧溶液の濃度であることを意味します。これは浸透圧とも呼ばれます。
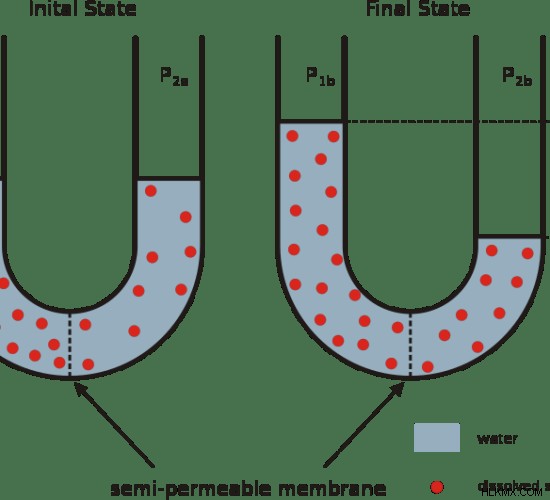
図 1:浸透
モル濃度とは異なり、浸透圧は 1 リットルあたりの粒子数を測定します。たとえば、NaCl 溶液を考えると、浸透圧はその溶液のモル濃度の 2 倍になります。これは、すべての粒子が考慮されるため、モル濃度が 1 リットルあたりの Na または Cl のモル数であるのに対し、浸透圧は 1 リットルあたりの (Na+Cl) モル数であるためです。
イオン性化合物の溶液を考える場合、すべてのイオンは特定のイオンではなく粒子と見なされます。粒子は、イオンまたは分子のいずれかです。しかし、分子構造を持つ化合物の溶液を考えると、化合物は溶解して分子を形成します。次に、各分子は粒子と見なされます。
たとえば、
- 1 リットルの水に 0.08 モルのブドウ糖が溶けている場合
グルコース溶液のモル濃度 =0.08 mol/L
グルコース溶液の浸透圧 =0.08 osmol/L
- 1 リットルの水に 0.08 モルの NaCl が溶けている場合
NaCl 溶液のモル濃度 =0.08 mol/L
NaCl 溶液の浸透圧 =0.16 osmol/L
浸透圧は、溶液に溶解している化合物の種類には依存しません。そこに存在する粒子の量を測定するだけです。ただし、溶媒(水)の変化の影響を受けます。これは、溶液の量が増減すると、それに応じて浸透圧の計算で考慮される量が変化するためです。さらに、化合物の体積と溶解度はこれらのパラメーターを変更することで変更できるため、浸透圧は温度と圧力にも依存します。
オスモラリティとは
浸透圧は、溶液質量に関する溶液の浸透圧を表すために使用される用語です。これは、溶液 1 キログラムあたりのオスモル数として定義できます。オスモルは、その溶液中に存在する粒子のモル数です。粒子は、イオンまたは分子のいずれかです。
質量は圧力と温度に依存しないため、これら 2 つのパラメーターは溶液の浸透圧に影響を与えることはできません。しかし、水分含有量の変化は、溶液の質量を変化させるため、浸透圧に大きな影響を与える可能性があります。この特性は、任意の温度および圧力条件で正確に浸透圧を決定するのに有利です。
浸透圧は凝固点降下法で簡単に測定できます。これは、溶質と溶液の凝固点の間接的な比例に基づいています (溶液中の溶質が多いほど、凝固点は低くなります)
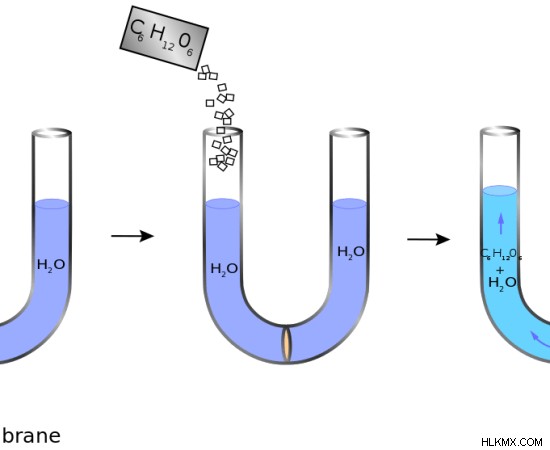
図 2:化合物が水に溶解すると浸透圧が発生します。
浸透圧の単位は osmol/kg です。浸透圧は、溶液の質量に関する溶液中の溶質の濃度を示します。
浸透圧と浸透圧の関係
- 非常に希薄な溶液の場合、浸透圧と浸透圧は数値的に同じです。
- 浸透圧と浸透圧の差は浸透圧ギャップと呼ばれます。
浸透圧と浸透圧の違い
定義
浸透圧: 浸透圧は、溶液 1 リットルあたりの溶質粒子のオスモルとして表される溶液の濃度です。
浸透圧: 浸透圧は、キログラムあたりの溶質粒子の総数として表される溶液の濃度です。
計算
浸透圧: 浸透圧は、溶液の体積を考慮して計算されます。
浸透圧: 浸透圧は、溶液の質量を考慮して計算されます
ユニット
浸透圧: 浸透圧の単位は mol/L です。
浸透圧: 浸透圧の単位は osmol/L です。
温度と圧力
浸透圧: 浸透圧は温度と圧力に依存します。
浸透圧: 浸透圧は温度と圧力に依存しません。
結論
浸透圧と浸透圧の両方を使用して、システムの浸透圧を決定します。それらは、溶液の濃度をオスモルで表します。ただし、この記事で前述したように、これらにはいくつかの違いがあります。浸透圧と浸透圧の主な違いは、浸透圧は溶液の体積を考慮して測定されるのに対し、浸透圧は溶液の質量を考慮して測定されることです。







