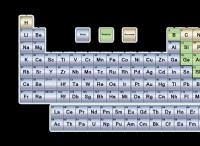
1。グループ(列):
* アルカリ金属(グループ1): +1イオンを形成するために1つの電子を容易に失う高反応金属。それらは、水、酸素、およびハロゲンと激しく反応します。
* アルカリアース金属(グループ2): 2つの電子を失って+2イオンを形成する反応性金属。それらは水と反応しますが、アルカリの金属よりも激しく反応します。
* 遷移金属(グループ3-12): さまざまな酸化状態を示します。つまり、異なる数の電子を失う可能性があります。それらの反応性は大きく異なります。
* ホウ素グループ(グループ13): 通常、+3イオンを形成しますが、他の酸化状態を示すこともできます。
* カーボングループ(グループ14): 有機分子を含む幅広い化合物を形成します。金属と非金属の両方として機能することができます。
* 窒素群(グループ15): 3つの電子を獲得して-3イオンを形成する傾向がある非金属。それらはさまざまな化合物を形成します。
* 酸素グループ(グループ16): -2イオンを形成するために2つの電子を獲得する傾向がある非金属。 特に金属を使用すると、高度に反応性があります。
* ハロゲン(グループ17): 1つの電子を容易に獲得して-1イオンを形成する非常に反応性のない非金属。それらは金属と反応して塩を形成します。
* nobleガス(グループ18): 完全な外側の電子シェルのため、非常に反応性がありません。彼らはめったに化学反応に参加しません。
2。期間(行):
* 期間を超えて移動: 要素は、金属が少なくなり、非金属性が高くなります。これは、電子を獲得し、陰イオンを形成する可能性が高いことを意味します。
* 期間を下る: 金属文字が増加します。 元素は電子を失い、陽性イオンを形成する可能性が高くなります。
3。 その他の要因:
* 電気陰性度: 原子が結合中に電子を引き付ける能力。 電気陰性度が高いということは、元素が陰イオンを形成する可能性が高いことを意味します(陰イオン)。
* イオン化エネルギー: 原子から電子を除去するために必要なエネルギー。イオン化エネルギーが低いということは、元素が電子を失い、陽イオンを形成する可能性が高いことを意味します(正のイオン)。
* 電子親和性: 電子が原子に追加されるときのエネルギーの変化。 電子親和性が高いということは、要素が電子を獲得し、陰イオンを形成する可能性が高いことを意味します。
例:
* ナトリウム(Na): グループ1、高反応金属、容易にNa+イオンを形成します。 水と激しく反応して、水酸化ナトリウムと水素ガスを生成します。
* 塩素(cl): グループ17、高反応性非金属、容易に形成されます。ナトリウムと反応して塩化ナトリウム(テーブル塩)を形成します。
* 炭素(c): グループ14は、4つの結合を形成する能力により、多種多様な化合物を形成します。 それは多くの有機反応に関与しています。
* ヘリウム(He): グループ18は、その外側のシェルが完全に非アクティブではありません。化学反応に参加することはめったにありません。
周期表に上の要素の位置とそれに関連する特性を理解することにより、それが参加する可能性が高い反応の種類と、結果の製品の性質を予測できます。