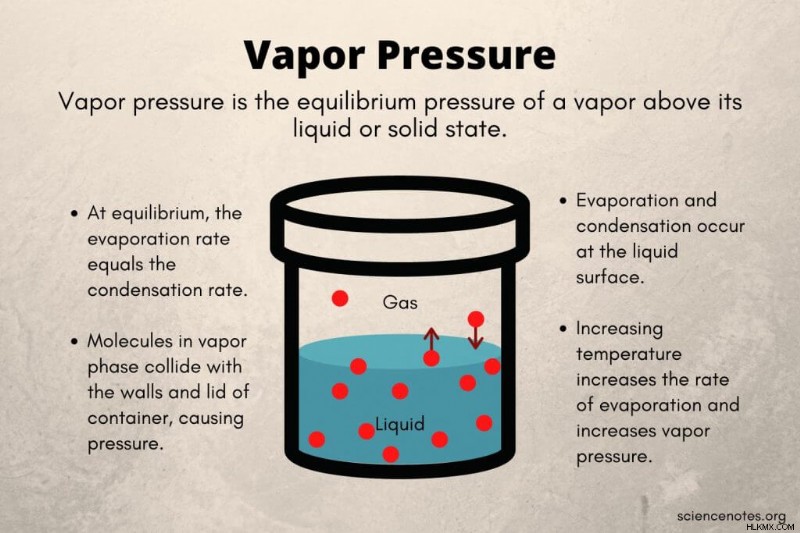
蒸気圧 (または蒸気圧) は、密閉容器内の液体または固体状態を超える蒸気の平衡圧力です。このタイプの閉鎖系では、液体または固体の一部の分子が十分な運動エネルギーを持っているため、表面から逃げて蒸気 (気体) 相に入ります。一方、一部の蒸気分子は、液体または固体の表面と衝突して相を変化させます。蒸気分子の運動エネルギーにより、蒸気分子が容器の壁や蓋に衝突し、蒸気圧が発生します。
液体 (または固体) から逃げる分子の数が、気相から液体 (または固体) に戻る分子の数と等しくなる点が、飽和蒸気圧 です。 .密閉容器では、飽和蒸気圧で蒸発率と凝縮率が等しくなります。開いた容器では、温度が沸点に達するまで、温度が上昇するにつれて蒸気圧が上昇します。飽和蒸気圧は沸点温度で発生し、これは大気圧に依存します。したがって、1 気圧では、水の飽和蒸気圧は 100 C (212 F) で発生します。言い換えれば、蒸気圧は液体の沸点における大気圧と同じです。
蒸気圧の高い物質は揮発性であると言われています .揮発性物質の例としては、ガソリンや消毒用アルコール (液体)、パラジクロロベンゼン (固体) などがあります。開いた容器では、蒸気として逃げる液体の分子が容器に衝突して平衡圧力に達することはありません。代わりに、蒸気分子が蒸発します。不揮発性液体は蒸気圧が水よりも低く、ゆっくりとしか蒸発しません。揮発性液体は蒸気圧が高く、すぐに蒸発します。
蒸気圧に影響する要因
蒸気圧に影響を与える最も重要な要因は、温度と分子の種類です:
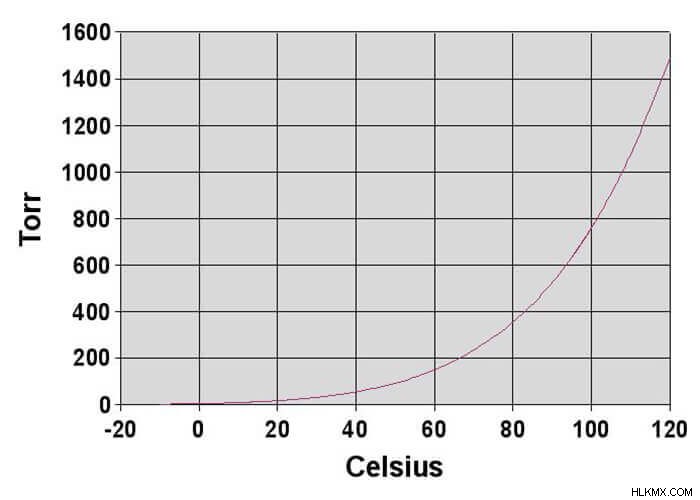
- 気温 :温度は蒸気圧に最も大きな影響を与えます。温度が上昇すると、蒸気圧が上昇します。温度が下がると、蒸気圧が下がります。熱エネルギーを与えると分子により多くの運動エネルギーが与えられるため、これは理にかなっています。蒸気圧と温度の関係のグラフは曲線です。ただし、蒸気圧と温度の自然対数のグラフは直線です。
- 分子間力 :分子間の力、つまり物質の化学組成が蒸気圧に影響します。たとえば、水には強力な水素結合が含まれているため、分子間に作用する分子間力が弱いガソリンよりも蒸気圧が低くなります。
そうでない要素もあります 蒸気圧への影響:
- 液体または固体の量 :物質の量は物質の蒸気圧に影響しません。たとえば、水滴の蒸気圧は水たまりの蒸気圧と同じです。
- 表面積 :表面積は蒸気圧に影響しません。ただし、表面積が大きい場合は、表面積が小さい場合よりも蒸発がはるかに速くなります。たとえば、グラスに入った水は、同じ量の水をカウンターにこぼした場合よりも蒸発に時間がかかります。
水の蒸気圧
水の蒸気圧はその温度に依存します。室温 (25 C) での水の蒸気圧は、23.8 mm Hg、0.0313 atm、または 23.8 torr、または 3.17 kPa です。凝固点 (0 C) での水の蒸気圧は 4.6 torr です。沸点 (100 C) での水の蒸気圧は 658.0 torr (大気圧) です。
蒸気圧値の表
この表は、室温付近 (20-25 C または 68-77 F) の液体の蒸気圧値を示しています:
| 液体 | 蒸気圧 (kPa) |
| アセトアルデヒド | 120 |
| 酢酸 | 2.1 |
| アセトン | 30 |
| 酢酸アミル | 0.47 |
| アニリン | 0.09 |
| ビール | 2.4 |
| ベンゼン | 14 |
| 臭素 | 28 |
| 1-ブタノール | 0.93 |
| 二硫化炭素 | 48 |
| 四塩化炭素 | 15.3 |
| クロロホルム | 26 |
| シクロヘキサノール | 0.9 |
| エタノール | 12.4 |
| エチレングリコール | 0.007 |
| ギ酸 | 5.7 |
| イソプロピルアルコール | 4.4 |
| 灯油 | 0.7 |
| メタノール | 16.9 |
| ミルク | 2.4 |
| ニトロベンゼン | 0.03 |
| オクタン | 1.9 |
| ペンタン | 58 |
| フェノール | 0.05 |
| 海水 | 2.4 |
| スチレン | 0.85 |
| テトラクロロエタン | 0.7 |
| テトラクロロエチレン | 2.5 |
| トルエン | 3.8 |
| トリクロロエチレン | 9.2 |
| 水 | 2.4 |
蒸気圧の計算方法
蒸気圧の式はいくつかありますが、2 つの一般的な式は、ラウールの法則とクラウジウス-クラペイロンの式です。
ラウールの法則を使用して蒸気圧を計算する
Raoult の法則は、溶液の蒸気圧に関するものです (Psolution ) から溶媒の蒸気圧 (Psolvent ) と溶媒のモル分率 (Xsolvent ):
P解決策 =P溶媒 X溶媒
たとえば、1 リットルの水と 1 リットルのスクロースからなる単純なシロップの溶液の蒸気圧を求めてください。
まず、溶媒のモル分率を見つけます。この場合、溶媒は水です。
- 1 リットルの水の質量:1000 グラム
- ショ糖 1 リットルの質量:1056.7 g
- モル (水):1000 グラム × 1 モル/18.015 g =55.51 モル
- モル (スクロース):1056.7 グラム × 1 モル/342.2965 g =3.08 モル (化学式 C12 からスクロースのモル質量を使用) H22 O11 .)
- 総モル:55.51 + 3.08 =58.59 モル
- 水のモル分率:55.51/58.59 =0.947
次に、溶媒の蒸気圧を求めます。これを行う最も簡単な方法は、テーブルで値を検索することです。 25 C での水の蒸気圧は 23.8 mm Hg です。
次に、値を Raoult の法則に当てはめます。
- Pソリューション =P溶媒 X溶媒
- Pソリューション =(23.8 mm Hg)(0.947)
- Pソリューション =22.54 mm Hg
Clausius-Clapeyron の式を使用して蒸気圧を計算する
クラウジウス・クラペイロンの式は、温度の上昇に伴う蒸気圧の上昇に関連しています。自然対数 (ln) は、蒸気圧と温度の間の非線形関係を線形関係に変更します。
ln P =-(ΔHvap /R)(1/T) + C
- lnP は蒸気圧の自然対数です
- ΔH蒸気 は蒸発エンタルピーです
- R は理想気体定数または普遍気体定数 [8.314 J/(mol•K)]
- T は絶対温度 (ケルビン) です
- C は y 切片で、特定の線に対して一定です
2 点の蒸気圧と温度を測定すると、蒸発エンタルピーを求めることができます。同様に、ある温度での蒸発エンタルピーと蒸気圧がわかれば、別の温度での蒸気圧を求めることができます。
ln(P1 /P2 ) =-(ΔH蒸気 /R)(1/T1 – 1/T2 )
通常、この種の問題には、圧力対温度の自然対数をグラフ化し、結果のチャートで目的の値を調べることが含まれます。直線 (C) の傾きは ΔHvap です。 .または、ΔHvap を提供する参考文献を調べます とある温度での蒸気圧。
参考文献
- Perry, R.H.;グリーン、D.W.、編。 (1997)。 ペリーの化学エンジニアのハンドブック (第7版)。マグロウヒル。 ISBN 978-0-07-049841-9。
- ペトルッチ、ラルフ H.;ハーウッド、ウィリアム・S。 Herring, F. Geoffrey (2002)。 一般化学 (第8版)。プレンティス・ホール。 ISBN 978-0-13-014329-7.
- Sinnot, R.K. (2005)。 化学工学設計 (第4版)。バターワース・ハイネマン。 ISBN 978-0-7506-6538-4.
- Wagner, W. (1973)。 「アルゴンと窒素の新しい蒸気圧測定と、合理的な蒸気圧方程式を確立するための新しい方法」. 低温学 . 13 (8):470–482. doi:10.1016/0011-2275(73)90003-9