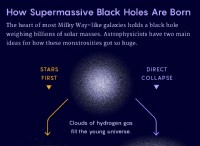
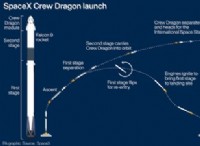
その理由は次のとおりです。
* so₂は分子(中性化合物)です: 二酸化硫黄(SO₂)は分子であり、全体的な電荷がないことを意味します。
* so₂の硫黄の酸化数は+4:です これを決定するために、酸化数を割り当てるためのルールを使用します。
*酸素の酸化数は通常-2です。
*So₂はニュートラルであるため、酸化数の合計はゼロに等しくなければなりません。
* Xを硫黄の酸化数とします。
*方程式は次のとおりです:x + 2(-2)=0
* xを解くと、x =+4を取得します。
したがって、so₂の硫黄の酸化数は+4です。
ただし、Soはイオンを形成するために反応することができます:
* 亜硫酸イオン(so₃²⁻): 亜硫酸イオンでは、硫黄の酸化数は+4です。
* 他の硫黄含有イオン: So₂は反応して、硫黄の酸化数が異なる他のイオンを形成することができます(例:硫酸イオン、So₄²⁻、ここで硫黄の酸化数は+6)。
要約:
* so₂(二酸化硫黄): 硫黄の酸化数は+4です。
* so₃²⁻(亜硫酸イオン): 硫黄の酸化数は+4です。
* 他の硫黄含有イオン: 硫黄は、特定のイオンに応じてさまざまな酸化数を持つことができます。