1。 「解離しない」という用語は、通常、単純化しすぎです。 イオン化合物が低い解離を持っていると言う方がより正確です または弱く解離します 。
2。解離に影響する要因:
* 溶解度: イオン化合物がより溶解しないほど、それはより多く分離します。 不溶性化合物は最小限の解離を示します。
* 溶媒の極性: 水のような極性溶媒は、非極性溶媒よりもイオン化合物の溶解と解離に優れています。
* 電荷密度: 電荷密度が高く(電荷が大きいイオンが小さい)、イオン間のより強い魅力につながり、解離の可能性が低くなります。
* 格子エネルギー: 高い格子エネルギー(より強いイオン結合)は、化合物が解離する可能性が低いことを示しています。
3。低解離の指標:
* 弱い電解質: 弱く解離したイオン化合物の溶液は、電荷を運ぶための遊離イオンが少ないため、電気を不十分に実行します。
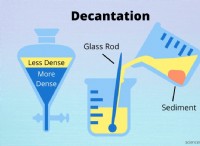
* 沈殿: イオン化合物が特定の溶媒に不溶性である場合、解離する代わりに沈殿物が形成されます。
* 特定の例: 塩化水銀(II)のような特定のイオン化合物(HgCl 2 )および塩化銀(AGCL)は、水中の解離が低いことが知られています。
要約:
- 完全に完全に「解離しない」イオン化合物はありません。
- 溶解度、溶媒極性、電荷密度などの要因は解離に影響します。
- 弱い電解質と沈殿物は、低解離の指標です。
イオン化合物が「不溶性」と見なされていても、それはまだ少し溶解し、いくつかの解離をもたらすことを覚えておくことが重要です。