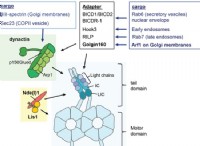
* イオン化の程度: 硫酸は強酸です 、つまり、溶液中に完全にイオン化し、多数の水素イオン(H⁺)と硫酸イオン(SO₄²⁻)を放出します。これらのイオンは自由に移動して電流を運ぶことができます。一方、クエン酸は弱酸 。溶液中に部分的にのみイオン化し、硫酸と比較してはるかに少ないイオンを生成します。
* イオンの濃度: 両方の酸が同じモル濃度である場合でも、硫酸のイオンが高いほど、遊離イオンのはるかに高い濃度につながります。これは、より良い電気伝導率に直接変換されます。
* 構造と極性: 硫酸の構造により、遊離イオンの解離と形成が容易になります。 2つの酸性プロトンがあり、簡単に分離することができ、より高い導電率に寄与します。複数のカルボキシル基を備えたクエン酸の構造により、すべてのプロトンを完全にイオン化および放出することがより困難になります。
要約: 硫酸の強酸性、完全なイオン化、および溶液中のイオンの濃度が高いほど、クエン酸と比較してはるかに優れた電気導体になります。