主な違い – 一酸化窒素と亜酸化窒素 (笑気ガス)
一酸化窒素と亜酸化窒素は窒素の酸化物です。窒素は原子番号 7 の化学元素であり、元素周期表の p ブロックの非金属です。異なる酸化物中の窒素は、異なる酸化状態を持っています。酸化状態は、特定の原子が別の原子と失う、獲得する、または共有できる電子の数です。一酸化窒素では、窒素原子は酸素原子と 2 つの電子を共有します。したがって、一酸化窒素中の窒素の酸化状態は+2です。 対照的に、亜酸化窒素の窒素の酸化状態は +1 です .これが一酸化窒素と亜酸化窒素の主な違いです。
対象となる主な分野
1.一酸化窒素とは
– 定義、化学的性質、反応
2.亜酸化窒素(笑気ガス)とは
– 定義、化学的性質、反応
3.一酸化窒素と亜酸化窒素の類似点は何ですか
– 共通機能の概要
4.一酸化窒素と亜酸化窒素の違いは何ですか
– 主な違いの比較
重要な用語:原子度、原子番号、一酸化二窒素、笑気ガス、一酸化窒素、窒素、亜酸化窒素、酸化状態、酸素

一酸化窒素とは
一酸化窒素は、化学式 NO を持つ窒素酸化物です。ここでは、1 つの窒素原子が共有結合を介して酸素原子に結合しています。これは、窒素原子と酸素原子が不対電子を共有していることを意味します。室温と圧力では、一酸化窒素は有毒な無色のガスです。

図 1:一酸化窒素のルイス ドット構造
この化合物のモル質量は 30 g/mol です。一酸化窒素の融点は-164°C、沸点は-152°Cです。一酸化窒素分子は、互いに結合している原子が 2 つしかないため、線形の形をしています。窒素と酸素の不対電子が共有されている場合、窒素原子には別の不対電子があります。しかし、共有する酸素原子には他に不対電子はありません。次に、不対電子は、2 つの原子の間で単独で共有されます。したがって、共有結合の実際の構造は、二重結合と三重結合の間にあります。この場合、結合長は 115 pm で、2 つの原子間の距離が期待値よりも短くなっています。
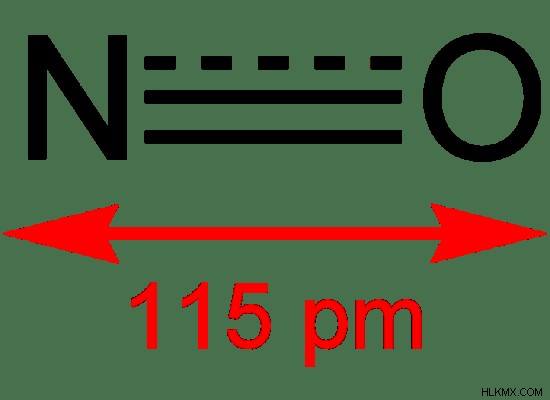
図 2:一酸化窒素における窒素と酸素の実際の結合
一酸化窒素は、酸素の存在下で二酸化窒素を形成できます。しかし水中では、一酸化窒素は酸素と H2 と反応します。 亜硝酸 (HNO2 )。このガスが冷却されると、一酸化窒素二量体 (N
一酸化窒素中の窒素の酸化状態は +2 です。これは、酸素の酸化状態が -2 であり、亜酸化窒素分子が中性化合物であるため、窒素の酸化状態は +2 である必要があるためです。
亜酸化窒素 (笑気ガス) とは
亜酸化窒素は、化学式 N2 を持つ窒素酸化物です。 O. 亜酸化窒素の IUPAC 名は 一酸化二窒素 です .このガスは笑気とも呼ばれます 軽度のヒステリー、時には笑いによって進行する痛みに鈍感になるからです。
この気体のモル質量は 44 g/mol です。常温常圧で無色の気体です。亜酸化窒素の融点は -90.86 °C、沸点は -88.48 °C です。 N2 O分子は、2つの窒素原子と1つの酸素原子で構成されています。窒素原子は互いに結合しており、酸素原子は2つの窒素原子のうちの1つに結合しています。これらの原子間の化学結合を考えると、N2 ○は共鳴を示す。この分子には 2 つの主要な共鳴構造があります。

図 3:亜酸化窒素の共鳴構造
しかし、実際の構造はこれらの構造のハイブリッドです。
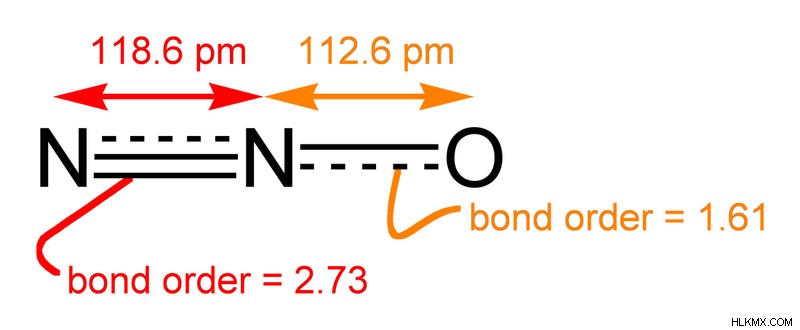
図 4:亜酸化窒素の実際の構造
亜酸化窒素は、室温および圧力で不活性ガスと見なされ、化学反応はほとんどありません。しかし、温度が上昇すると、その反応性も上昇します。たとえば、187 °C では、亜酸化窒素は NaNH2 と反応します。 アジ化ナトリウム (NaN3 ).
亜酸化窒素の窒素の酸化状態は +1 です。酸素の酸化状態は-2で、亜酸化窒素分子は中性化合物です。次に、式のバランスをとるために、両方の窒素原子の酸化状態は +2 でなければなりません。
亜酸化窒素の酸化状態 =0
酸素原子の酸化状態 =-2
したがって、
N2O =2(N) + (O)
0 =2(N) + (-2)
2(N) =+2
(N) =+1
一酸化窒素と亜酸化窒素の類似点
- どちらも室温と圧力で無色の気体です。
- どちらも窒素原子と酸素原子で構成されています。
- どちらも共有化合物です。
一酸化窒素と亜酸化窒素の違い
定義
一酸化窒素: 一酸化窒素は、化学式 NO を持つ窒素酸化物です。
亜酸化窒素: 亜酸化窒素は、化学式 N2 を持つ窒素の酸化物です。 O.
モル質量
一酸化窒素: 一酸化窒素のモル質量は 30 g/mol です。
亜酸化窒素: 亜酸化窒素のモル質量は 44 g/mol です。
融点と沸点
一酸化窒素: 一酸化窒素の融点は-164°C、沸点は-152°Cです。
亜酸化窒素: 亜酸化窒素の融点は-90.86 °C、沸点は-88.48 °Cです。
原子性
一酸化窒素: 一酸化窒素の原子数は 2 です。
亜酸化窒素: 亜酸化窒素の原子数は 3 です。
窒素の酸化状態
一酸化窒素: 一酸化窒素の窒素の酸化状態は +2 です。
亜酸化窒素: 亜酸化窒素の窒素の酸化状態は +1 です。
結論
窒素は、周期表の 5 族の非金属元素です。多くの酸化物化合物を形成することができます。一酸化窒素と亜酸化窒素はそのような2つの化合物です。一酸化窒素と亜酸化窒素の主な違いは、一酸化窒素の窒素の酸化状態が +2 であるのに対し、亜酸化窒素の窒素の酸化状態は +1 であることです。