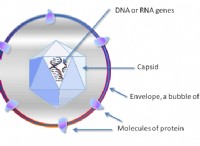
分子間力とその役割
* 極性共有分子 電子密度の不均一な分布を持ち、部分的な正と部分的な負の端(双極子モーメント)を作成します。
* 分子間力(IMFS) 分子間の引力です。これらの力は分子内の分子内の力(結合)よりも弱いが、物質の物質状態を決定する上で重要である。
* より強いIMFS 分子間の魅力を克服し、状態を変えるためにより多くのエネルギーが必要であるため、より高い融点と沸点につながります。
分子間力の種類
* 双極子型力: これらは、ある分子の正の端と別の分子の負の端の間の引力のために、極分子間で発生します。
* 水素結合: これは、水素原子が酸素、窒素、またはフッ素のような高電気陰性原子に結合したときに発生する特別なタイプの双極子双極子相互作用です。水素結合は特に強いです。
なぜ極性共有分子が液体である傾向がある
1。より強いIMF: 極性共有分子には、双極子型力があり、時には水素結合があります。これらは、非極性分子の間に存在する弱いロンドン分散力よりも強いです。
2。より高い沸点: 極性分子のIMFが強いほど、アトラクションを克服し、ガスになるためにより多くのエネルギーが必要です。これは、より高い沸点につながり、室温で液体として存在する可能性が高くなります。
例:
* 水(h₂o): 強い水素結合を伴う高度に極性分子。これが、比較的低い分子量を持っているにもかかわらず、水が室温で液体である理由です。
対照的に:
* 非極性分子: メタン(Ch₄)のような非極性分子は、ロンドン分散力が弱いだけです。これらの弱い魅力により、室温で気体状態に簡単に移行できます。
結論:
極性共有分子のより強い分子間力、特に双極子双極子相互作用と水素結合は、それらのより高い沸点に寄与し、非極性分子と比較して液体状態に存在する可能性が高くなります。