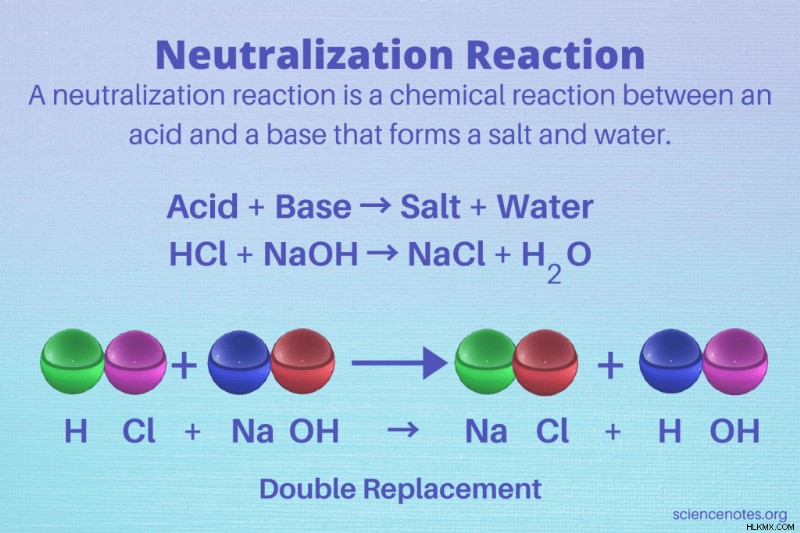
中和反応 製品として塩と水を形成する酸と塩基の間の化学反応です。言い換えれば、反応は酸と塩基を中和します。中和反応は、反応物が酸と塩基である二重置換反応の一種です。
酸は水中で水素イオンを放出し、塩基は水酸化物を放出します。水素と水酸化物は結合して水を形成しますが、酸からの陰イオンと塩基からの陽イオンは塩であるイオン化合物を形成します。中和は、酸と塩基の両方が水に少なくとも部分的に溶解する場合にのみ発生します。反応の生成物である塩は、可溶性であるか、沈殿物を形成する場合があります.
強酸と強塩基が完全に反応すると、結果は中性 pH (pH ~7.0) の水溶液になります。ただし、多くの中和反応により、溶液の pH 値が低くなったり高くなったりします。
酸塩基中和反応
一般に中和反応は、酸と塩基(アルカリ)の二重置換反応の一種です。反応の一般的な形式は、酸と塩基が反応して塩と水を形成することです:
酸 + 塩基 → 塩と水
例:
HCl + NaOH → NaCl + H2 O
あるいは、反応をイオン方程式として書くこともできます:
H(aq) + Cl(aq) + ナ( aq) + OH(aq) → Na(aq) + Cl(aq) + H2 O(l)
スペクテーター イオンをキャンセルすると、正味のイオン方程式は次のようになります。
H(aq) + OH(aq) → H2 O(l)
反応矢印が右を指していることに注意してください。これは、反応が順方向にのみ進行することを示しています。
Brønsted-Lowry 酸塩基理論に基づく反応の一般的な形式は次のとおりです。
ああ + B → A + BH
強酸 – 強塩基中和
強酸と強塩基は水中で完全に解離して反応し、中性水溶液中で中性塩を形成します。最終的な pH 値は約 7 ですが、温度によって若干高くなったり低くなったりする可能性があります。
以下は、最も一般的な強酸と強塩基です。それらが互いに反応すると、最終的な pH 値は 7 になると予想されます。他のほとんどの酸と塩基を反応させると、7 以外の pH になります。
| 強酸 | 強力なベース |
|---|---|
| HCl | LiOH |
| HBr | NaOH |
| こんにちは | コウ |
| HCIO4 | RbOH |
| HNO3 | CsOH |
| Ca(OH)2 | |
| Sr(OH)2 | |
| Ba(OH)2 |
硫酸 (H2 SO4 ) は水素原子が 2 つあるため、他の強酸とは異なる挙動を示します。硫酸は完全に解離しますが、段階的に解離します。
弱酸 – 弱塩基中和
弱酸と弱塩基は水中で完全には解離しません。代わりに、弱酸とその共役塩基および/または弱塩基とその共役酸を含む平衡混合物が形成されます。
AH + B ⇌ A + BH
2 つの種が互いに完全に中和するわけではありません。弱酸と弱塩基の中和反応のpH値は、弱酸と弱塩基の強さに依存します。 Ka =Kb の場合のみ pH は 7 です。弱塩基が強い場合 (Kb> Ka)、最終的な溶液はアルカリ性 (pH> 7) になります。弱酸はより強く (Ka> Kb)、最終溶液は酸性 (pH <7) です。
弱酸と強塩基
弱酸と強塩基の間の中和反応の最終的な pH は、弱酸の強さに依存します。
ああ + H2 O ⇌ H3 O+A
強酸と弱塩基
強酸と弱塩基の間の中和反応の最終的な pH は、塩基の酸解離定数 pKa に依存します。
H3 O + B ⇌ H2 O + BH
pH 値の予測
中和反応の pH は、反応物の特性によって異なります:
| 酸と塩基の強さ | pH |
|---|---|
| 強酸 – 強塩基 | 7 |
| 強酸 – 弱塩基 | <7 |
| 弱酸 – 強塩基 | >7 |
| 弱酸 – 弱塩基 | pH <7 if Ka>Kb Ka=Kb の場合 pH =7 Ka |
強酸と弱塩基との反応で pH が低く、弱酸と強塩基との反応で pH が高い理由は そうではありません 強酸または強塩基のためです。代わりに、結果として生じる塩が pH に影響を与えるためです。弱酸の共役塩基は溶液をアルカリ性にします。弱塩基の共役酸は、溶液を酸性にします。
中和の生成物を予測する方法
中和反応に関して生徒がよく受ける 2 つの質問は、反応の生成物を予測することと、最終的な pH が酸性、アルカリ性、または中性のいずれであるかを予測することです。
<オール>たとえば、塩酸 (HCl) と水酸化アルミニウムの反応生成物 [Al(OH)3] を特定します。 ] および最終的な pH が酸性、中性、またはアルカリ性であるかどうか。
チャートまたは記憶から、塩酸は強酸であり、水酸化アルミニウムは強塩基ではないことを知っています (したがって、弱塩基である必要があります)。強酸と弱塩基の反応の pH は 7 未満であるため、pH は酸性です。
塩酸は H と Cl に解離し、水酸化アルミニウムは Al と 3 OH に解離します。塩は、塩基 (Al) からの陽イオンと酸 (Cl) からの陰イオンを結合し、AlCl
酸 (H) のモル数が塩基 (OH) のモル数と等しいと仮定して式のバランスをとります。
3HCl + Al(OH)3 → AlCl3 + H2 O
日常生活における中和反応の例
中和反応は日常生活でよく見られます。
- 制酸剤テーブルには、胃内の過剰な胃酸 (HCl) を中和する弱塩基 (炭酸水素ナトリウムなど) が含まれています。
- 人間の消化器系も胃酸を中和します。膵臓は、腸での栄養吸収を可能にする重炭酸制酸剤を生成します。
- 重炭酸ナトリウムなどの弱塩基は、酸のこぼれや火傷を安全に中和します。
- 歯磨き粉には、口内の細菌が放出する酸を中和する弱塩基が含まれています。
- 水酸化カルシウムまたは石灰岩 (炭酸カルシウム) は、pH を上げて植物の成長を助ける土壌処理剤です。
- 肥料の生産には、硝酸または硫酸のいずれかをアンモニアで中和し、硝酸アンモニウムまたは硫酸アンモニウムを形成することが含まれます。
- スクラバーは、石炭の燃焼から生じる酸を中和します。
- 滴定は、未知の溶液の濃度を特定する中和反応です。
参考文献
- トルマル、アレクサンダー。リッピング、ラウリ。カルジュランド、イヴァリ; Koppel、Ilmar A.;レイト、イヴォ (2016)。 「水中の強酸とジメチルスルホキシドの酸性度」。 The Journal of Physical Chemistry A . 120 (20):3663–3669。 doi:10.1021/acs.jpca.6b02253
- Skoog, D.A.;ウェスト、DM;ホラー、J.F.; Crouch, S.R. (2004)。 分析化学の基礎 (第8版)。トムソン・ブルックス/コール。 ISBN 0-03-035523-0.
- Snoeyink, V.L.; Jenkins, D. (1980)。 水生化学:天然水中の化学平衡と比率 .ニューヨーク:ワイリー。 ISBN 0-471-51185-4.
- Zumdahl, Steven S. (2009). 化学原理 (第6版)。ニューヨーク:ホートン ミフリン カンパニー