主な違い - 励起とイオン化ポテンシャル
励起ポテンシャルとイオン化ポテンシャルは、化学元素の電子と原子核の関係を説明するために化学で使用される 2 つの用語です。原子核は、陽子と中性子で構成されています。したがって、それらは正に帯電しています。特定のエネルギー準位に沿って原子核の周りを移動する電子があります。電子は負に帯電しています。励起とは、エネルギーを吸収することによって、電子が低エネルギー準位から高エネルギー準位に移動することです。原子を基底状態から励起状態に移動させます。イオン化エネルギーは、中性気体原子からの電子の除去です。これにより陽イオンが生成されます。電子が取り除かれると、原子は原子の正電荷を中和する負電荷を持たなくなります。励起とイオン化ポテンシャルの主な違いは、励起は低エネルギー準位から高エネルギー準位への電子の移動を説明するのに対し、イオン化ポテンシャルはエネルギー準位からの電子の完全な除去を説明することです。
対象となる主な分野
1.興奮とは
– 定義、説明、電磁スペクトル
2.イオン化ポテンシャルとは
– 定義、第一イオン化エネルギー、第二イオン化エネルギー
3.励起電位とイオン化電位の違いは何ですか
– 主な相違点の比較
重要な用語:原子核、電磁スペクトル、電子、励起、励起状態、基底状態、イオン化エネルギー、イオン化ポテンシャル

興奮とは
化学において、励起とは、原子核、原子、分子などの系に離散量のエネルギーを加えることです。励起は、システムのエネルギーを基底エネルギー状態から励起エネルギー状態に変化させます。
系の励起状態には、エネルギーの分布ではなく離散値があります。これは、原子 (または上記の他のシステム) がエネルギーの特定の部分を吸収した場合にのみ励起が発生するためです。例えば、電子を励起状態に移動させるために与えなければならないエネルギー量は、基底状態と励起状態のエネルギー差に等しい。与えられたエネルギーがこのエネルギー差に等しくない場合、励起は発生しません。
電子と同じように、原子核の陽子と中性子は、必要な量のエネルギーが与えられると励起されます。しかし、原子核を励起状態にするために必要なエネルギーは、電子のエネルギーに比べて非常に高い.
エネルギーの高い励起状態は安定ではないため、系が長時間励起状態にとどまることはありません。したがって、システムはこのエネルギーを解放して基底状態に戻る必要があります。エネルギーは、光子としての量子エネルギーの放出の形で放出されます。それは通常、可視光またはガンマ線の形で発生します。この戻りは減衰と呼ばれます。衰退は励起の逆です。
電磁スペクトル
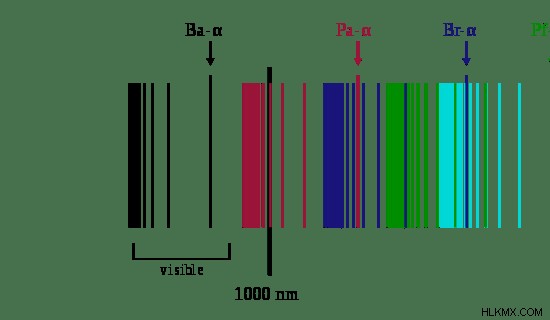
図 1:水素の電磁スペクトル
電子がエネルギーを吸収して励起状態になると、同じ量のエネルギーを放出して基底状態に戻ります。この放出されたエネルギーは、電磁スペクトルの形成につながります。電磁スペクトルは一連の線です。各線は、基底状態に戻るときに放出されるエネルギーを示します。
イオン化ポテンシャルとは
イオン化ポテンシャルまたはイオン化エネルギーは、中性の気体原子から最も緩く結合した電子を取り除くのに必要なエネルギー量です。この電子は、原子核から最も遠くにある電子であるため、価電子です。中性原子のイオン化により、陽イオンが形成されます。
この電子の除去は、エネルギーが外部から吸収される吸熱プロセスです。したがって、イオン化ポテンシャルは正の値です。一般に、電子が原子核に近づくほど、イオン化ポテンシャルが高くなります。
周期表の元素には、第一イオン化エネルギー、第二イオン化エネルギー、第三イオン化エネルギーなどのイオン化ポテンシャルがあります。最初のイオン化エネルギーは、陽イオンを形成する中性気体原子から電子を除去するのに必要なエネルギー量です。その原子の 2 番目のイオン化エネルギーは、最初のイオン化後に形成された陽イオンから電子を除去するために必要なエネルギー量です。

図 2:周期表の最初のイオン化エネルギーの変化
一般に、イオン化エネルギーは周期表のグループの下に向かって減少します。これは、原子サイズの増加によるものです。原子サイズが大きくなると、原子核から最も遠い電子への引力が減少します。そうすれば、その電子を簡単に取り除くことができます。したがって、必要なエネルギーが少なくなり、イオン化ポテンシャルが低下します。
しかし、周期表の周期に沿って左から右に進むと、イオン化エネルギーのパターンがあります。イオン化エネルギーは、元素の電子配置によって異なります。たとえば、第 2 族元素のイオン化エネルギーは、第 1 族元素および第 3 族元素のイオン化エネルギーよりも高くなります。
励起とイオン化ポテンシャルの違い
定義
興奮: 励起とは、原子核、原子、分子などの系に離散量のエネルギーを追加することです。
イオン化ポテンシャル: イオン化ポテンシャルは、中性の気体原子から最も緩く結合した電子を除去するのに必要なエネルギー量です。
目的
興奮: 励起は、低エネルギー準位から高エネルギー準位への電子の移動を説明します。
イオン化ポテンシャル: イオン化ポテンシャルは、エネルギー準位からの電子の除去を完全に説明します。
エネルギー変化
興奮: 励起には外部からのエネルギーが必要ですが、このエネルギーはすぐに光子として放出されます。
イオン化ポテンシャル: イオン化ポテンシャルは、原子が吸収するエネルギー量であり、再び放出されることはありません。
製品の安定性
興奮: 励起は、不安定で寿命の短い励起状態を形成します。
イオン化ポテンシャル: イオン化ポテンシャルは、電子の除去後、ほとんどの場合安定しているカチオンを形成します。
結論
化学における励起ポテンシャルとイオン化ポテンシャルは、化学元素のエネルギー変化と原子挙動の関係を説明するために使用される 2 つの用語です。励起とイオン化ポテンシャルの主な違いは、励起は低エネルギー準位から高エネルギー準位への電子の移動を説明するのに対し、イオン化ポテンシャルはエネルギー準位からの電子の完全な除去を説明することです.
参照:
1.「興奮」。ブリタニカ百科事典、ブリタニカ百科事典、2006 年 8 月 17 日、こちらから入手可能。
2. 「興奮状態。」ウィキペディア、ウィキメディア財団、2018 年 1 月 22 日、こちらから入手可能。
3. 「イオン化エネルギー」イオン化エネルギーはこちらから入手できます。
画像提供:
1. OrangeDogによる「水素スペクトル」 – アップローダーによる自作。に対する λ の対数プロット。ここで、n′ は 1 ~ 6 の範囲、n は n′ + 1 ~ の範囲、R は w:Rydberg 定数 (CC BY-SA 3.0)、Commons Wikimedia 経由
2. “First Ionization Energy” By Sponk (PNG ファイル)Glrx (SVG ファイル)Wylve (zh-Hans, zh-Hant)Palosirkka (fi)Michel Djerzinski (vi)TFerenczy (cz)Obsuser (sr-EC, sr-EL, hr) . png by Sponk (CC BY 3.0)、Commons Wikimedia 経由







