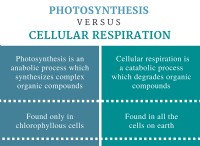
グループ:
* アルカリ金属(グループ1): +1イオンを形成するために1つの電子を容易に失う高反応金属。彼らは水と空気に激しく反応します。例:リチウム(Li)、ナトリウム(NA)、カリウム(K)。
* アルカリアース金属(グループ2): 2つの電子を失って+2イオンを形成する反応性金属。それらはアルカリの金属よりも反応性が低いです。例:ベリリウム(BE)、マグネシウム(MG)、カルシウム(CA)。
* ハロゲン(グループ17): 1つの電子を獲得して-1イオンを形成する非金属。特に金属では非常に反応性があります。例:フッ素(F)、塩素(Cl)、臭素(BR)。
* nobleガス(グループ18): 満たされた外側の電子殻を備えた不活性ガス。安定した電子構成のため、それらは非常に非アクティブです。例:ヘリウム(彼)、ネオン(NE)、アルゴン(AR)。
期間:
*同じ期間内の要素には、同じ数の電子シェルがあります。それらの化学的特性は同じグループの要素ほど類似していませんが、期間にわたって反応性やその他の特性には傾向があります。たとえば、電気陰性度は期間にわたって左から右に増加します。
その他の要因:
* 遷移金属: これらの要素(グループ3-12)は、結合におけるD-電子の関与により、より多様で複雑な化学的特性を示しています。
* ランタニドとアクチニド: これらの要素は、F電子のために同様の化学的特性を持っています。
要約:
周期表は、元素の繰り返しの化学的特性に基づいて編成されています。 同じグループの要素は、類似した電子構成のために非常に類似した化学的特性を持つ傾向がありますが、同じ期間の要素は反応性やその他の特性の傾向を示しています。