珪藻分子:
* H₂(水素ガス): 両方の水素原子は電子を等しく共有し、非極性共有結合をもたらします。
* o₂(酸素ガス): 両方の酸素原子は等しい電気陰性度を持ち、電子の等しい共有につながります。
* n₂(窒素ガス): 酸素と同様に、窒素原子は電子を等しく共有し、非極性共有結合を形成します。
* cl₂(塩素ガス): 両方の塩素原子は同じ電気陰性度を持ち、電子の同等の共有をもたらします。
* f₂(フッ素ガス): 両方のフッ素原子は電子を等しく共有し、非極性共有結合を形成します。
* br₂(臭素ガス): 両方の臭素原子は同じ電気陰性度を持ち、電子の等しい共有をもたらします。
* i₂(ヨウ素ガス): 両方のヨウ素原子は電子を等しく共有し、非極性共有結合を形成します。
多原子分子:
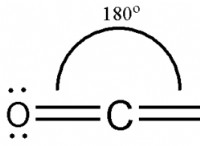
* co₂(二酸化炭素): 炭素酸素結合は極性ですが、分子の線形形状と電子密度の対称分布により、全体の分子は非極性になります。
* ch₄(メタン): 炭素水素結合はわずかに極性ですが、分子の対称四面体形状は双極子モーメントをキャンセルし、メタンを非極性にします。
* c₂h₆(エタン): メタンと同様に、エタンの対称構造は極性効果をキャンセルし、非極性にします。
非極性共有結合の重要な要因:
* 等しい電気陰性度: 結合に関与する原子は、同様の電気陰性度値を持たなければなりません。 これは、彼らがほぼ同じ強度で電子を引き付けることを意味します。
* 対称分子形状: 分子内の個々の結合がわずかに極性であっても、双極子が互いにキャンセルするため、対称的な形状は全体的に非極性分子をもたらす可能性があります。
重要な注意:
これらの例は、非極性共有結合の概念を示していますが、真に100%非極性結合はほとんどありません。 実際には、ほとんどの債券にはある程度の極性があります。ただし、原子間の電気陰性度の違いが十分に小さく、結合が本質的に非極性と見なされる場合、結合を「非極性」に分類します。