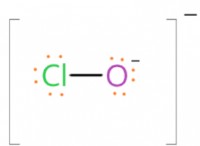1。物理的特性:
* 融点と沸点: 強い結合(イオン性または共有結合など)は、より多くのエネルギーを壊す必要があり、より高い融点と沸点につながります。
* 硬度: 強い結合を持つ材料は、通常、結合が弱いものよりも硬い材料です。
* 溶解度: 溶媒に溶解する物質の能力は、溶質分子と溶媒分子間の相互作用の種類の影響を受けます。極性分子(極結合を含む)は、水のような極性溶媒に溶解する傾向がありますが、非極性分子(非極性結合を含む)は、油のような非極性溶媒に溶解します。
* 導電率: イオン化合物は、イオンが自由に移動できるため、溶融または水に溶解すると電気を伝達します。一方、共有化合物は、非常に極性であるか、非局在化された電子を持っていない限り、一般的に貧弱な導体です。
* 密度: 密度は、物質の分子の梱包の影響を受けます。強い絆はしばしば密度の高い材料につながります。
2。化学的特性:
* 反応性: 結合の強さは、分子が他の物質とどれほど容易に反応するかを決定します。 結合が弱くなると壊れやすく、反応性が高くなります。
* 安定性: 強い結合を持つ分子は一般により安定しており、分解する可能性が低くなります。
* 極性: 電子が不均一に共有される極性結合は、他の極性分子またはイオンと相互作用できる極性分子を生じます。これは、さまざまな化学反応に関与する分子の能力に影響します。
例:
* ダイヤモンド対グラファイト: どちらも炭素原子で作られていますが、結合は異なります。ダイヤモンドでは、各炭素は四面体の配置で4つの強力な共有結合を形成し、非常に困難です。グラファイトでは、炭素原子は結合が弱い平面シートを形成し、柔らかくてフレーク状にします。
* 水(h₂o): 水中の極性共有結合は、水分子間の強い水素結合を生み出し、溶融点と沸点が高く、表面張力が高く、溶媒として作用する能力をもたらします。
* 塩化ナトリウム(NaCl): 塩化ナトリウムのイオン結合は、融点が高い硬くて脆い固体になります。イオンと水分子の間の強い魅力のために、それは容易に水に溶けます。
要約:
分子の結合は、その構造とそれが他の分子と相互作用する方法を決定します。これは最終的に、融点、硬度、導電率、反応性、溶解度などの巨視的特性に影響します。