その理由は次のとおりです。
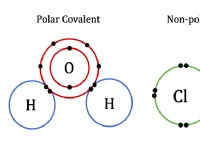
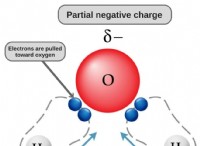
* 強酸: 完全に水で解離します。つまり、酸のすべての分子がそのプロトン(H+)を溶液に放出します。 例:HCL、HNO3、H2SO4。
* 弱酸: 部分的に水でのみ解離します。つまり、酸性分子のごく一部のみがプロトンを放出します。 例:酢酸(CH3COOH)、炭酸酸(H2CO3)、ギ酸(HCOOH)。
弱酸が完全に解離しないのはなぜですか?
理由は平衡にあります それは解離プロセスに存在します:
`` `
ha(aq)⇌h +(aq) + a-(aq)
`` `
* ha 弱酸を表します。
* h+ プロトン(水素イオン)を表します。
* a- 酸の共役ベースを表します。
二重矢印(⇌)は、反応が可逆的であることを示します。平衡の位置は、左に向かって大きくあります 弱酸の場合、ほとんどの酸分子は無関心のままです。
「ベースへの瞬間的な変化」について :
弱酸が即座に水中のベースに変化すると言うのは正確ではありません。弱酸の解離は段階的なプロセスであり、平衡によって支配されます。弱酸が解離すると、その共役ベース(a-)を形成します。この塩基は水と反応して酸を改善することができますが、平衡は常に酸のない形を支持します。
要約 :
* 強酸: 完全に解離し、大量のH+イオンを形成します。
* 弱酸: 部分的に分離し、少量のH+イオンを形成し、ほとんどが分類されていない形で残ります。
「弱い」という用語は、それらが取るに足らないことを意味しないことを覚えておくことが重要です。 弱酸は、さまざまな生物学的および化学的プロセスで重要な役割を果たします。