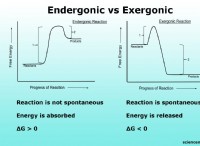
ここに:
* 電気促進性: これは、元素が電子を失い、陽イオン(陽イオン)を形成する傾向を指します。電気促進率が高い元素は、陽イオンをより容易に形成する傾向があります。
* カチオンとアニオン: 化合物は、正の帯電イオン(陽イオン)と負に帯電したイオン(アニオン)の間の静電引力によって形成されます。
* 式規則: より高い電気促進性(陽イオンを形成する可能性が高い)を持つ要素は、通常、化学式で最初に記述されています。これは、陽イオンが電子を陰イオンに「供与」するという考えを反映しています。
例:
* naCl(塩化ナトリウム): ナトリウム(Na)は塩素(Cl)よりも電気依存症であるため、陽イオン(Na+)を形成し、最初に書かれています。
* cao(酸化カルシウム): カルシウム(Ca)は酸素(O)よりも電気依存症であるため、陽イオン(Ca2+)を形成し、最初に書かれています。
* fe2O3(鉄(iii)酸化物): 鉄(Fe)は酸素(O)よりも電気依存症であるため、陽イオン(Fe3+)を形成し、最初に書かれています。
例外:
* 非金属要素を持つ化合物: 非金属要素を含むいくつかの化合物では、電気陰性要素が少なくなる可能性があります。たとえば、塩化水素(HCl)では、塩素はより電気陰性ですが、水素が最初に書かれています。
* 分子化合物: 分子化合物は、必ずしもこの規則に従うとは限りません。それらの式は、通常、分子に存在する各要素の原子の数によって決定されます。
キーテイクアウト: 一般的なルールは、化学式で最初に正の酸化数を含む要素を記述することです。ただし、例外があるため、特定の化合物とその特性を確認することは常に良いことです。