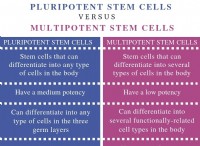
1。電気陰性度:
* グループ1および2: 電気陰性度が低いことを意味します。つまり、電子の魅力が弱いことを意味します。
* グループ16および17: 電気陰性度が高いことを意味します。つまり、電子に強い魅力があります。
電気陰性度のこの違いは、イオン結合の形成につながります 、1つの原子(金属)が電子を失い、正に帯電したイオン(陽イオン)になり、もう1つの原子(非金属)が電子を誘導して負に帯電したイオン(アニオン)になります。
2。安定した電子構成:
* グループ1および2: アルカリ金属(グループ1)は、安定した貴重なガス構成を実現するために1つの電子を失う必要があります。アルカリ地球金属(グループ2)は、安定性を達成するために2つの電子を失う必要があります。
* グループ16および17: カルコジェン(グループ16)は2つの電子を獲得する必要があり、ハロゲン(グループ17)は、安定した貴重なガス構成を実現するために1つの電子を獲得する必要があります。
結果:
これらの因子の組み合わせは、イオン化合物の形成を促進します。金属は電子を容易に無属に失い、両方に電子の安定した配置をもたらします。
例:
* naCl(塩化ナトリウム): ナトリウム(グループ1)は1つの電子を失い、Na+になり、塩素(グループ17)は1つの電子を獲得してCl-になります。結果の化合物はテーブルソルトです。
* mgo(酸化マグネシウム): マグネシウム(グループ2)は2つの電子を失い、mg2+になり、酸素(グループ16)が2つの電子を獲得してO2-になります。
キーテイクアウト: 電子を獲得または失うことにより、電気陰性度とこれらの元素が安定した電子構成を達成する傾向の有意な違いは、グループ1&2とグループ16および17の間の膨大な配列の形成を促進します。