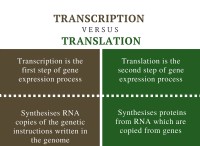
* 水の極性: 水分子は極性です。つまり、わずかに正の端(水素原子の近く)とわずかに負の端(酸素原子の近く)があります。この極性により、水分子はイオンとの強力な静電相互作用を形成することができます。
* イオン結合: 塩化ナトリウムは、反対に帯電したイオン(Na+およびCl-)の間の静電魅力であるイオン結合によって結合されています。これらの結合は強力ですが、水分子とイオンの間の魅力ほど強くはありません。
* 水分補給: 塩化ナトリウムを水に加えると、水分子がイオンを囲み、水和シェルを形成します。水分子の正の末端は塩化物イオン(Cl-)と相互作用し、負の末端はナトリウムイオン(Na+)と相互作用します。この水分補給プロセスは、イオン結合を弱め、塩を溶かすことを可能にします。
要約: 水分子とイオンの間の強い魅力は、水の極性により、塩化ナトリウムをつなぐイオン結合を克服し、溶解につながります。