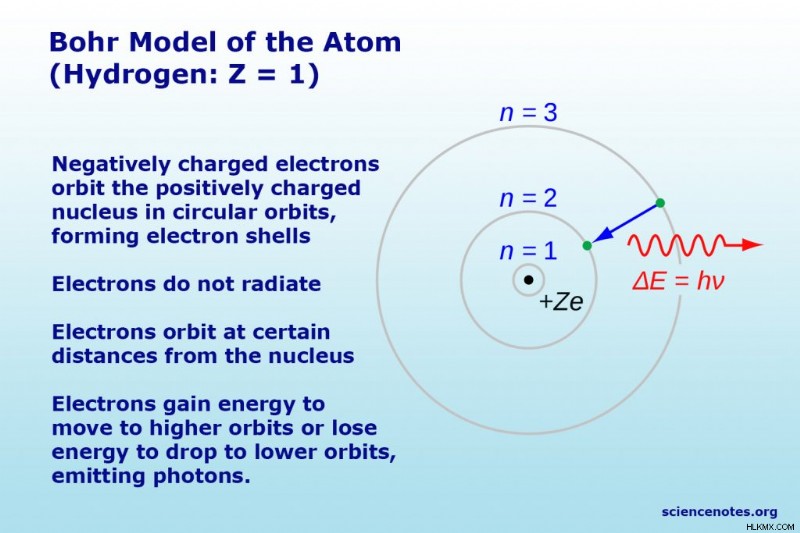
原子のボーアモデルまたはラザフォード-ボーアモデルは、主に量子論の観点から原子の構造を説明するケーキまたは惑星モデルです。惑星が太陽を周回するように電子が原子核を周回し、円形の電子軌道がケーキの層のように殻を形成するため、惑星またはケーキ モデルと呼ばれます。デンマークの物理学者 Niels Bohr は 1913 年にこのモデルを提案しました。
ボーア模型は、いくつかの量子力学を組み込んだ最初の原子模型でした。初期のモデルは、キュービック モデル (1902 年)、プラム プディング モデル (1904 年)、土星モデル (1904 年)、およびラザフォード モデル (1911 年) でした。最終的に、完全に量子力学に基づくモデルがボーア モデルに取って代わりました。それでも、電子の量子挙動を簡単な言葉で説明し、水素のスペクトル輝線のリュドベリ式を説明しているため、これは重要なモデルです。
ボーア モデルの要点
- 原子核は陽子と中性子で構成され、正味の正電荷を持っています。
- 電子は負の電荷を持ち、原子核の周りを回っています。
- 電子の軌道は円形ですが、すべての電子が同じ平面内を周回するわけではなく (星の周りの惑星のように)、電子が見つかる可能性のある球体または殻ができます。恒星の周りの惑星の軌道は重力によって決まりますが、静電力 (クーロン力) によって電子が原子核を周回します。
- 電子の最低エネルギー (最も安定した状態) は、原子核に最も近い最小軌道にあります。
- 電子がある軌道から別の軌道に移動するとき、エネルギーは吸収 (低い軌道から高い軌道への移動) または放出 (高い軌道から低い軌道への移動) されます。
水素のボーア模型
ボーア モデルの最も単純な例は、水素原子 (Z =1) または水素様イオン (Z> 1) であり、負に帯電した電子が小さな正に帯電した原子核を周回します。モデルによると、電子は特定の軌道のみを占有します。可能な軌道の半径は、n の関数として増加します。ここで、n は主量子数です。電子がある軌道から別の軌道に移動すると、エネルギーが吸収または放出されます。 3 → 2 遷移は、バルマー シリーズの最初の行を生成します。水素 (Z =1) の場合、この線は波長 656 nm (赤) の光子で構成されます。
重い原子のボーア モデル
水素原子には陽子が 1 つしか含まれていませんが、重い原子にはより多くの陽子が含まれています。原子は、複数の陽子の正電荷を打ち消すために追加の電子を必要とします。ボーア模型によると、各軌道には特定の数の電子しか保持されません。レベルが満たされると、追加の電子が次に高いレベルを占めます。そのため、より重い電子のボーア模型では電子殻が導入されます。これは、原子がより多くの陽子と電子を含んでいるにもかかわらず、周期表の周期 (行) を横切って左から右に移動すると原子が小さくなる理由など、重い原子のいくつかの特性を説明しています。このモデルは、希ガスが不活性である理由、周期表の左側の原子が電子を引き付ける理由、右側の元素 (希ガスを除く) が電子を失う理由も説明します。
ボーアモデルをより重い原子に適用する際の問題の 1 つは、モデルが電子殻が相互作用しないと仮定していることです。したがって、このモデルでは、電子が規則的に積み重ならない理由を説明できません。
ボーア モデルの問題
ボーア モデルは以前のモデルを凌駕し、吸収スペクトルと発光スペクトルを記述しましたが、いくつかの問題がありました:
- モデルは大きな原子のスペクトルを予測できませんでした。
- ゼーマン効果を説明していません。
- スペクトル線の相対強度は予測しません。
- このモデルは、電子の半径と軌道の両方を定義するため、ハイゼンベルグの不確定性原理に違反しています。
- 基底状態の角運動量を正しく計算しません。ボーア モデルによると、基底状態の角運動量は L です。 =ħ .実験データは L=0 を示しています。
- ボーア模型は、スペクトル線の微細および超微細構造を説明しません。
ボーア モデルの改良
ゾンマーフェルトまたはボーア・ゾンマーフェルトモデルは、元のボーアモデルを大幅に改善し、円軌道ではなく楕円電子軌道を記述しました。これにより、ゾンマーフェルト モデルは、スペクトル線分割におけるシュタルク効果などの原子効果を説明できるようになりました。しかし、ゾンマーフェルト モデルは磁気量子数に対応できませんでした。
1925 年、ヴォルフガングのパウリの原子モデルがボーア モデルとそれに基づくモデルに取って代わりました。パウリのモデルは純粋に量子力学に基づいていたため、ボーア モデルよりも多くの現象を説明しました。 1926 年、Erwin Schrodinger の方程式は波力学を導入し、今日使用されているパウリのモデルの修正につながりました。
参考文献
- ボーア、ニールス (1913)。 「原子と分子の構成について、パートI」。 哲学雑誌 . 26 (151):1–24. doi:10.1080/14786441308634955
- ボーア、ニールス (1914)。 「ヘリウムと水素のスペクトル」。 自然 . 92 (2295):231–232. doi:10.1038/092231d0
- ラクタキア、アフレシュ。サルピーター、エドウィン E. (1996)。 「水素のモデルとモデラー」。 American Journal of Physics . 65 (9):933。ビブコード:1997AmJPh..65..933L。 doi:10.1119/1.18691
- ポーリング、ライナス (1970)。 「第5章1節」。 一般化学 (第3版)。サンフランシスコ:W.H. Freeman &Co. ISBN 0-486-65622-5.