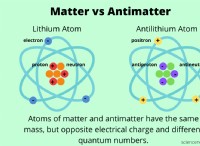
* 酸の形成: 非金属酸化物が水と反応すると、酸を形成します。これは、非金属酸化物が水と組み合わせて、酸性特性の原因となる水素イオン(H+)を生成するためです。
* 例:
* 二酸化炭素(CO2): CO2は水に溶けて炭酸(H2CO3)を形成します。
* 二酸化硫黄(SO2): SO2は水に溶けて硫酸(H2SO3)を形成します。
* 二酸化窒素(NO2): NO2は水に溶けて硝酸(HNO3)を形成します。
例外:
* 一部の非金属酸化物は、中性またはわずかに基本的な溶液を形成する可能性があります。 これは、pHバランスに影響を与える可能性のある特定のイオンの形成によるものです。たとえば、一酸化炭素(CO)は水にわずかに溶けているだけで、強酸を形成しません。
キーテイクアウト:
いくつかの例外がありますが、一般的なルールは、非金属酸化物が水中に酸性溶液を形成するということです。