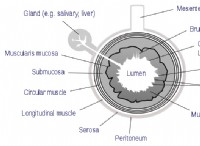
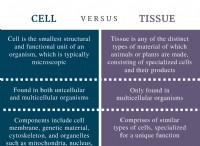
これが化学的方程式です:
zn(s) +cuso₄(aq)→znso₄(aq) + cu(s)
説明:
* 亜鉛(Zn) 銅よりも反応性が高いため、電子を失う傾向が高くなります。
*反応では、亜鉛原子は2つの電子(酸化)を失い、亜鉛イオン(Zn²⁺)になります。
*これらの亜鉛イオンは、硫酸銅(II)から硫酸イオン(So₄²⁻)と結合して硫酸亜鉛(Znso₄)を形成します。
*一方、銅(II)からの銅(II)イオン(cu²⁺)硫酸イオン(還元)が2つの電子(還元)を獲得し、銅原子(Cu)になります。
*銅原子は、亜鉛の表面に赤茶色の固形堆積物を形成します。
この反応は、で観察できます
*亜鉛金属を硫酸銅(II)の溶液に入れます。
*亜鉛金属が徐々に溶解し、表面上の銅の赤い茶色のコーティングが溶解することがわかります。
注: 溶液が加熱されると、反応はより速く進行します。