硫酸イオンの検査とは何かという質問に答えるために、この記事では硫酸イオン (SO4 ) イオン。これらの試験方法のほとんどすべては、硫酸塩を他の化学試薬と反応させることにより、視覚的な観察を伴います。沈殿法は、硫酸イオンの分析に広く使用されています。金属沈殿物のいくつかは、希塩酸や希硝酸に不溶であるなどのユニークな特性を持っています。炭酸塩、リン酸塩、亜硫酸塩の反応は同じではありません。これらの方法は、硫酸塩を他のものと区別するために使用できます。これらのテスト方法のいくつかは、非常に敏感です。少量でも識別できます。
硫酸イオンのテスト
水中の硫酸イオンのテスト – 水への金属硫酸塩の溶解度
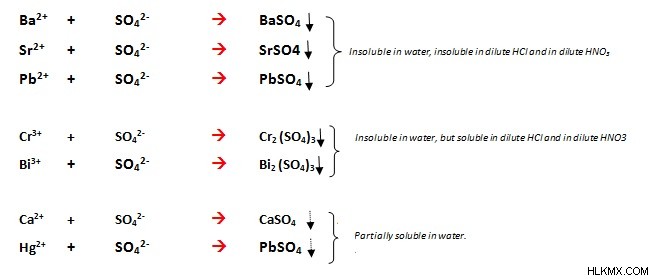
バリウム (BaSO4)、ストロンチウム (SrSO4)、鉛 (PdSO4) の硫酸塩は水に溶けず、カルシウム (CaSO4) と水銀 (HgSO4) の硫酸塩は水に部分的に溶けます。水。他の金属硫酸塩のほとんどは水に溶けます。水銀、ビスマス、クロムなどの塩基性硫酸塩の一部は水に溶けませんが、これらの硫酸塩は希硝酸または希塩酸に溶解します。
硫酸イオンの塩化バリウム試験
塩化バリウム (BaCL2 )を硫酸塩溶液に加えると、白色の沈殿物が形成されます。温かい希塩酸と希硝酸には溶けませんが、沸騰すると溶けます。
Ba2 + + SO4 —> BaSO4 ↓(白)
このテストは通常、希塩酸を加えて酸性媒体で実施されます。炭酸塩 (CO3)、亜硫酸塩 (SO3)、およびリン酸塩 (PO4) は、この条件下では沈殿しません。
硫酸バリウムの過マンガン酸カリウム試験
過マンガン酸カリウム (KMnO4) の存在下で硫酸バリウムが沈殿すると、過マンガン酸の一部を吸収した後、ピンク色 (紫) に変わります。表面に吸着した過マンガン酸塩は、一般的な還元剤では還元できません。過酸化水素でさえ、還元のための有効な試薬ではありません。表面に吸着されない過剰な過マンガン酸カリウムは、一般的な還元剤と容易に反応します。したがって、ピンク色の硫酸バリウムは無色の媒体ではっきりと見えます。
硫酸イオンの酢酸鉛テスト
酢酸鉛を硫酸塩溶液に加えると、硫酸鉛の白色の沈殿物が形成されます。熱濃硫酸、酢酸アンモニウム溶液、水酸化物溶液に溶けます。
Pb + SO4 —> PbSO4 ↓(白)
最後のケース (NaOH を含む PbSO4) では、テトラヒドロキソアルミン酸ナトリウム (II) が形成されます。塩酸で酸性化すると、塩化鉛が培地中で結晶化します。
PbSO4↓ + NaOH —> Na2 [Pb(OH)4 ] + SO4
硫酸イオンの硝酸銀試験
硝酸銀を硫酸塩溶液に加えると、硫酸銀の結晶沈殿物が形成されます。これは、濃縮溶液 (Ag2 の溶解度) でのみ発生します。 SO4 =18 C で 5.8 gl)。
Ag + SO4 —> Ag2 SO4 ↓
硫酸イオンの硝酸水銀試験
硝酸水銀を硫酸イオンの溶液に加えると、塩基性硫酸水銀 (HgSO4) の黄色の沈殿物が形成されます。
3Hg + SO4 + 2H2 O —> 4H+ HgSO4.2HgO ↓(黄色)
これは感度の高いテストであり、バリウムや硫酸鉛の懸濁液からでも観察できます.
硫酸塩の検査とは – まとめ
硫酸塩は、独特の溶解特性を持つ一部の金属イオンと沈殿物を形成します。すべての金属イオンで沈殿物を形成するわけではありませんが、バリウム、ストロンチウム、鉛 (BaSO4、SrSO4、PbSO4) では水不溶性の沈殿物を形成します。温かい希塩酸や硝酸には溶けませんが、温めると溶けます。一部の硫酸塩 (Bi2 (SO4)3、Cr2(SO4)3) は水に溶けませんが、希塩酸と希硝酸には溶けます。一部の硫酸塩 (HgSO4、CaSO4) は部分的に水に溶けます。硝酸水銀は、硫酸イオンの存在下で黄色の沈殿物を生成します。これは、濃度がかなり低い場合でも識別に使用できます。過マンガン酸カリウムが反応媒体中にある場合、塩化バリウムは硫酸塩とピンク色の沈殿物を形成します。