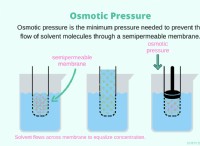
* 純粋な水は貧弱な導体です: 水自体は非常に弱い電解質であるため、電気はあまりうまくいきません。これは、自己イオン化により、非常に少数のイオン(H+およびOH-)しか存在しないためです。
* 酸放出イオン: 酸は、水に溶解すると、水素イオン(H+)を溶液に放出します。これらのイオンは、酸からの陰イオンとともに、溶液中の荷電粒子の濃度を増加させます。
* イオンの増加=導電率の増加: 溶液中に存在するイオンが多いほど、溶液は電気を導入します。 電荷キャリアの数が増えると、電流のより効率的な移動が可能になります。
例: 水に溶解した塩酸(HCl)は、H+およびCl-イオンに分離します。これらのイオンは、純水と比較して溶液の導電率を大幅に向上させます。
重要な注意: 導電率が増加する程度は、酸の強度と溶液の濃度に依存します。 HCLのような強酸は、酢酸のような弱酸と比較して、導電率のはるかに大きな増加につながります。