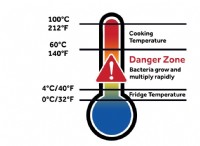
H2Sの形成の反応がどのように見えるかは次のとおりです。
h2(g) + s(s)→H2s(g)Δhf=-20.6 kj/mol
これが正しい理由を分解しましょう:
* H2(g): 水素ガスは、水素の標準状態です。
* s(s): その固体形態の硫黄は標準的な状態です。
* h2s(g): 硫化水素ガスは製品です。
* Δhf=-20.6 kj/mol: この負の値は、その元素からのH2Sの形成が発熱反応であり、エネルギーを放出することを示しています。
重要な注意: 形成のエンタルピーは、常に1モルの化合物の形成を参照しています。