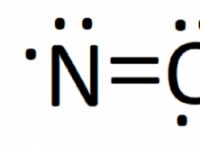1。水の極性:
*水分子(H₂O)は極性です。これは、彼らがわずかに正の端(水素原子の近く)とわずかに負の端(酸素原子の近く)を持っていることを意味します。
*この極性により、水分子はイオンと強く相互作用することができます。
2。イオン双極子相互作用:
*塩(NaCl)を水に加えると、水分子(水素原子)の正の端が負に帯電した塩化物イオン(CL-)に引き付けられます。
*同様に、水分子(酸素原子)の負の端は、正に帯電したナトリウムイオン(Na+)に引き付けられます。
*これらのアトラクションは、イオン双極子相互作用と呼ばれます。
3。格子エネルギーの克服:
*固体塩では、ナトリウムイオンと塩化物イオンは、結晶格子を形成する強力な静電力(イオン結合)によって結合されます。
*これらの力を克服し、イオンを分離するために必要なエネルギーは、格子エネルギーと呼ばれます。
*水の強いイオン双極子相互作用は、塩結晶のイオン結合を破壊するのに十分なエネルギーを提供できます。
4。水分補給:
*イオンが分離されると、それらは水分子に囲まれます。このプロセスは水和と呼ばれます。
*水分子は、イオンを互いに効果的に「シールド」し、それらが再結合しないようにします。
*イオンの水和は、非常に発熱プロセス(熱を放出)であり、全体的な溶解プロセスに寄与します。
要約:
塩結晶中の水分子とイオンとの間の強いイオン双極子相互作用がイオンをつなぎ合わせる格子エネルギーを克服するため、塩が水に溶けます。その後、分離されたイオンは水分補給によって安定化され、塩結晶が再形成されるのを防ぎます。