これが故障です:
* 溶解度: 溶解度とは、溶媒(水など)に溶解する物質(イオン化合物など)の能力を指します。
* イオン化合物: これらは、正の帯電イオン(陽イオン)と負に帯電したイオン(アニオン)の間の静電引力によって形成されます。
水中のイオン化合物の溶解度に影響する因子:
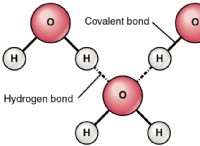
* 極性: 水は極性分子であり、それは正と負の端を持っていることを意味します。イオン化合物には電荷の分離もあり、極水分子に引き付けられます。この魅力は、彼らが解散するのに役立ちます。
* 格子エネルギー: イオン化合物の結晶構造内のイオン結合の強度。 高い格子エネルギーは、化合物が溶解する可能性が低いことを意味します。
* 水分補給エネルギー: 水分子がイオンを取り囲んで相互作用するときに放出されるエネルギー。 水分補給エネルギーが高いということは、化合物が溶解する可能性が高いことを意味します。
一般化:
* 一般に可溶性: アルカリ金属(Li、Na、Kなど)を含むイオン化合物、アンモニウム(NH₄⁺)、および硝酸イオン(no₃⁻)イオンは通常、水に溶けます。
* 一般的に不溶性: 銀(ag⁺)、鉛(pb²⁺)、水銀(hg²⁺)などの金属を含むハロゲン化物イオン(Cl⁻、br⁻、i⁻)を含むイオン化合物は通常不溶です。
* 例外: これらの一般化には多くの例外があります。たとえば、炭酸カルシウム(Caco₃)は、グループ2金属が含まれているにもかかわらず、水に不溶です。
要約: イオン化合物はしばしば水に不溶性と考えられていますが、それらの溶解度は、関与する特定のイオンやその他の要因によって大きく異なると言う方が正確です。