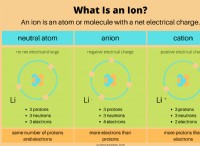
* 酸素の出発点: 酸素には8つの電子があり、構成2-6(最初のシェルに2つ、2番目に6つのシェルに6つの電子があります)。ネオン(2-8)のように安定するには、さらに2つの電子が必要です。
* イオン結合: 酸素は、2つの電子を獲得することによりこれを達成します。 これは通常、酸素が金属と相互作用するときに起こります。 金属は電子を失い、正に帯電したイオン(陽イオン)になります。電子を獲得した酸素は、負に帯電したイオン(アニオン)になります。
* 例:酸化マグネシウム(MGO)の形成
*マグネシウム(Mg)には2つの価電子(2-2)があります。
*マグネシウムはこれらの2つの電子を失い、mg²⁺(2-0)になります
*酸素はこれら2つの電子を獲得してO²⁻(2-8)になります
*反対の電荷が引き付けられ、イオン化合物MGOが形成されます。
* 結果: 現在は酸化物イオン(O²⁻)である酸素原子は、ネオン(2-8)と同じ電子構成を持っています。これにより、非常に安定しています。
キーポイント:
*イオン結合には、電子の伝達が含まれます。
*電子を獲得する原子は陰イオンになります。
*原子を失った電子は陽イオンになります。
*得られた化合物は、反対に帯電したイオン間の静電引力によって結合されます。