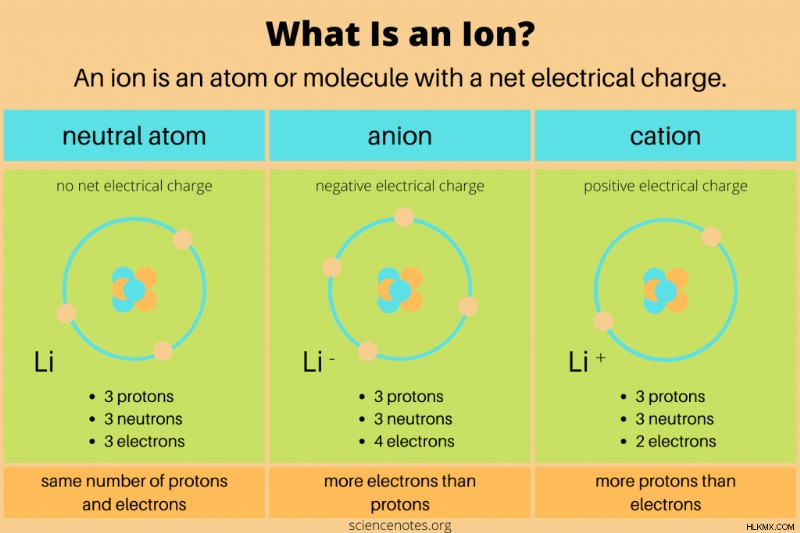
化学におけるイオンの定義 荷電した原子または分子です。これは、原子または分子の陽子と電子の数が等しくないことを意味します。中性子は正味の電荷を持たないため、イオンに直接影響を与えません。化学反応では、原子または分子が価電子を獲得または失うと、イオンが形成されます。核反応のみが化学種の陽子数を変更します。
陰イオンと陽イオン
イオンには、陰イオンと陽イオンの 2 種類があります。
- 陰イオン 正味の負電荷を持っています。陽子よりも多くの電子が含まれています。たとえば、17 個の陽子と 18 個の電子 (Cl) を持つ塩素原子は陰イオンです。陰イオンは、追加の電子殻を獲得すると、元の原子よりも大きくなる場合があります。
- 陽イオン 正味の正電荷を持っています。電子よりも多くの陽子が含まれています。たとえば、1 つの陽子とゼロの電子 (H) を持つ水素イオンは陽イオンです。陽イオンは元の原子よりも小さくなります。これは、核電荷が大きくなると電子がより近くに引き寄せられるためです。
陽イオンと陰イオンの定義を覚える 1 つの方法は、陽イオンの「t」を「+」記号のように考えることです。もう 1 つのオプションは、「陰イオン」を「陰イオン」のように覚えることです。
陰イオンと陽イオンは反対の電荷を帯びているため、互いに引き合います。陰イオンは他の陰イオンをはじき、陽イオンは他の陽イオンをはじきます。電場と磁場の両方が陰イオンと陽イオンに影響を与えます。
イオンの例
化学表記法は、元素記号または化学式に電荷がプラス (+) かマイナス (-) かを示す上付き文字と電荷の量を付けてイオンを示します。電荷が 1 の場合は、「+」または「-」記号のみを記載してください。以下にいくつかのイオンの例を示します:
- H+
- カ
- フェ
- フェ
- クル
- ぷ
- NH4
- H3 ああ
- HCO3
- SO4
単原子および多原子イオン
原子を 1 つだけ含むイオンは 単原子イオン です .単原子イオンの例には、H、O、および Cl が含まれます。複数のイオンを含むイオンは多原子イオンです または分子イオン。多原子イオンの例は、アンモニウム (NH4 )、ヒドロニウム (H3 O)、塩素酸塩 (CO3 )、および水酸化物 (OH)。
歴史
イオンという言葉は、ギリシャ語の ion に由来します。 またはイエナイ 、「行く」を意味します。英国の物理学者で化学者のマイケル・ファラデーは、1834 年に化学種が水溶液中で電極間を移動する方法を説明する方法としてこの用語を作り出しました。
ファラデーは、電極間を移動する粒子の性質を特定しませんでしたが、一方の電極で金属が溶解し、もう一方の電極で堆積することを確認しました。つまり、何らかの形で電流が物質の動きに影響を与えたのです。
参考文献
- シリスピー、チャールズ (ed.) (1970)。 科学伝記の辞書 (第 1 版)。ニューヨーク市:チャールズ・スクリブナーの息子。 ISBN 978-0-684-10112-5。
- James, Frank A. J. L. (ed.) (1991). マイケル・ファラデーの書簡 .巻。 2:1832-1840。 ISBN 9780863412493.
- Knoll、Glenn F. (1999)。 放射線の検出と測定 (第3版)。ニューヨーク:ワイリー。 ISBN 978-0-471-07338-3.
- マスタートン、ウィリアム。ハーレー、セシル (2008)。 化学:原理と反応 .センゲージ学習。 ISBN 0-495-12671-3.