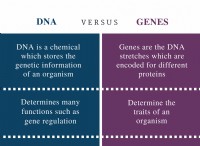
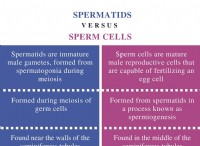
* 両方の反応物は水に溶けます。 塩化アンモニウムは可溶性塩であり、硫酸は水中で完全にイオン化する強酸です。
* 不溶性製品は形成されていません。 これらの2つの化合物間の反応は、硫酸アンモニウム((NH₄)₂So₄)、別の可溶性塩、および塩酸(HCl)の形成をもたらします。
反応方程式はです
2nh₄cl(aq) +h₂so₄(aq)→(nh₄)₂so₄(aq) + 2hcl(aq)
説明:
*塩化アンモニウムからのアンモニウムイオン(NH₄⁺)は、硫酸アンモニウムから硫酸アンモニウムを形成して硫酸イオン(So₄²⁻)と反応します。
*塩化アンモニウムからの塩化物イオン(Cl⁻)は、硫酸から水素イオン(H⁺)と反応して塩酸を形成します。
結論:
すべての製品は可溶性であるため、固体沈殿物の形成はありません。したがって、降水反応は発生しません。