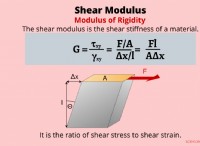
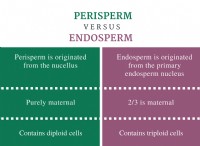
これが故障です:
* 硫酸(h₂So₄)は強力な双トロス酸です 、つまり、2つのプロトン(H⁺イオン)を寄付できます。これにより、2つのモルのNaOHと段階的に反応することができます。
* ステップ1: h₂so₄ + naoh→nahso₄ +h₂o(熱を放出)
* ステップ2: nahso₄ + naoh→na₂so₄ +h₂o(熱を放出)
* 塩酸(HCl)は強力な単プロ酸酸です 、つまり、1つのプロトンのみを寄付できます。 1つのモルのNaOHと1つのステップで反応します。
* HCl + NaOH→NaCl +H₂O(熱を放出)
なぜエンタルピーの違い?
* より強い酸、より多くの熱放出: 硫酸は塩酸よりも強い酸です。これは、水で解離し、H×イオンを形成すると、より多くのエネルギーを放出することを意味します。その結果、NAOHとの全体的な反応により、より多くの熱が放出されます。
* 段階的中和: NaOHによる硫酸の段階的中和は、より高いエンタルピー変化に寄与します。各ステップは、新しい塩の形成を伴い、熱を放出します。
要約:
反応のエンタルピーの違いは、主に酸の強度が異なり、硫酸が2つの陽子を供与する能力によるものであり、より複雑な反応をもたらし、総熱放出をもたらします。