その理由は次のとおりです。
* 酸 pHが低い(7未満)。それらは、水素イオン(H+)を溶液に放出し、溶液を酸性にします。
* ベース 高いpHを持っています(7以上)。彼らは溶液から水素イオン(H+)を受け入れ、溶液の酸性を減らします(より基本的な)。
酸に塩基を追加すると、塩基は酸によって放出される水素イオンと反応します。この反応により、溶液中の水素イオンの濃度が減少し、pHが増加し、溶液が酸性度を低下させます。
たとえば、
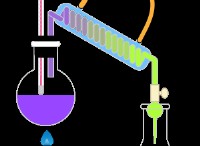
*水酸化ナトリウム(NaOH、強い塩基)を塩酸(HCL、強酸)に追加すると、次の反応が発生します。
NaOH + HCl→NaCl +H₂O
この反応は酸を中和し、pHを7に近づけます。
重要な注意:
特定のpHを維持するために追加する必要がある塩基の量は、酸の強度と濃度、および目的のpHに依存します。