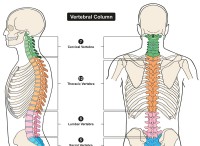
バッファーソリューションは、酸または塩基の添加時にpHの変化に抵抗するソリューションです。弱酸とその共役塩塩、または弱い塩基とその共役酸で構成されています。
これがどのように機能するかです:
* 弱酸/コンジュゲートベースバッファ: 強酸を加えると、コンジュゲート塩塩基は添加した水素イオン(H+)と反応して弱酸を形成します。これにより、H+が除去され、有意なpH低下が防止されます。同様に、強力な塩基が添加されると、弱酸が添加した水酸化物イオン(OH-)と反応して、コンジュゲートベースと水を形成します。これにより、OHが除去され、大幅なpH増加が防止されます。
* 弱塩基/コンジュゲート酸バッファー: メカニズムは類似しています。共役酸は添加されたOH-を中和しますが、弱い塩基は追加されたH+を中和します。
バッファシステムの例:
* 炭酸/重炭酸塩緩衝液: これは、人間の血液中の主要な緩衝システムであり、安定したpHを維持するのに役立ちます。
* リン酸緩衝液: 細胞内液で重要です。
* 酢酸/酢酸緩衝液: 実験室の設定で一般的に使用されます。
キーテイクアウト:
*バッファーは、追加された酸または塩基を消費することにより、pHの変化に抵抗します。
*それらは、弱酸/共役ベースまたは弱い塩基/共役酸ペアで構成されています。
*バッファーは、生物学的系および多くの化学反応で安定したpHを維持するために重要です。