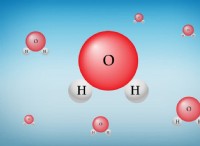
1。溶質と溶媒の間の相互作用: 水分子は極性です。つまり、電子の不均一な共有のために、陽性と負の終わりがあります。この極性により、水は他の極性分子またはイオンと相互作用することができます。
2。溶解: 溶質が水に加えられると、水分子が溶質粒子を囲みます。この相互作用は次のものが原因である可能性があります。
* 水素結合: これは、ある分子の水素原子が別の分子の高電気陰性原子(酸素のような)に引き付けられるときに起こります。水は、他の極性分子と容易に水素結合を形成します。
* イオン双極子相互作用: イオン(荷電粒子)は、水分子の反対に帯電した端に引き付けられます。
3。溶媒和: 水分子が溶質粒子を囲むと、それらは効果的にそれらを互いに分離し、溶液全体に分散します。このプロセスは溶媒和と呼ばれます。
4。溶液の形成: 溶解した溶質粒子は現在、水内で均等に分布しており、均一な混合物を形成しています。
水溶液を形成できる溶質の種類:
* イオン化合物: これらの化合物は、水に溶けたときにイオンに解離し、電気を伝導する溶液を作成します。例には、テーブル塩(NaCl)と水酸化ナトリウム(NaOH)が含まれます。
* 極性共有化合物: これらの化合物は、電子の不均一な共有により、部分的な正および負の電荷を持っています。それらは、水分子と水素結合を形成し、溶解することができます。例には、砂糖(C12H22O11)およびエタノール(C2H5OH)が含まれます。
* ガス: 一部のガスは水に溶けて水溶液を形成できます。例には、二酸化炭素(CO2)と酸素(O2)が含まれます。
溶解度に影響する要因:
* 温度: 一般に、溶解度は温度とともに増加します。
* 圧力: ガスの場合、溶解度は圧力の増加とともに増加します。
* 溶質と溶媒の性質: 極性溶質は極性溶媒に溶解し、非極性溶質は非極性溶媒(オイルなど)に溶解します。
要約すると、極水分子が溶質粒子と相互作用し、溶媒と溶液内の分布をもたらすと、水ベースの溶液が形成されます。溶質の種類と上記の要因は、物質が水にどれだけうまく溶解するかに影響します。