イオン化合物の理解
* 構造: イオン化合物は、正の帯電イオン(陽イオン)と負に帯電したイオン(アニオン)の間の静電引力によって形成されます。これらのイオンは、硬い結晶格子構造に配置されています。
* 固体状態: 固体状態では、イオンは所定の位置にロックされており、自由に動くことができません。これにより、電流の流れが防止されます。
液体状態での電気の導電性
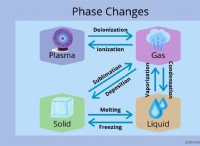
* 融解: イオン化合物が溶けると、イオンを保持する強い静電力が弱くなり、イオンが自由に動くことができます。
* 溶解: イオン化合物が極性溶媒(水など)に溶解すると、溶媒分子がイオンを囲み、溶媒分子を互いに分離します。これらの溶存イオンはモバイルになります。
それがどのように機能するか
1。遊離イオン: 溶融状態と溶存状態の両方で、イオンは自由に移動できます。
2。電界: 電位(電圧)が適用されると、正の帯電イオンは負の電極(カソード)に向かって移動し、負に帯電したイオンは正の電極(アノード)に向かって移動します。
3。電流フロー: 荷電粒子のこの動きは電流を構成し、イオン物質が電気を導入できるようにします。
重要なポイント
* 遊離電子なし: 電子が電荷キャリアである金属とは異なり、イオン物質はイオンの動きを通じて電気を伝達します。
* 電気分解: 電気を使用して化合物(水など)を分解するプロセスは、電気分解として知られています。このプロセスは、溶融または溶解したイオン化合物が電気を導入する能力に依存しています。
例:
*テーブルソルト(NaCl)は典型的なイオン化合物です。 水に溶けたり溶けたりすると、ナトリウムイオン(Na+)と塩化物イオン(CL-)が自由に移動できます。 電流は、溶融塩または塩水溶液を通ることができます。