主な違い - 共役と超共役
共役および超共役という用語は、不飽和有機化合物に関連しています。結合という用語は、化学ではさまざまな意味を持ちます。共役は、2 つの化合物を結合して 1 つの化合物を形成することを指す場合もあれば、σ 結合 (シグマ結合) を介した p 軌道の重なりを指す場合もあります。共役と超共役、つまりσ結合とπネットワークとの相互作用を比較しているため、この記事では共役の2番目の定義を検討します。したがって、共役と超共役の主な違いは、共役は σ 結合を横切る p 軌道の重なりであるのに対し、超共役は σ 結合と pi ネットワークとの相互作用であることです。
対象となる主な分野
1.活用とは
– 定義、シグマ ボンド、メカニズム
2.超共役とは
– 定義、説明
3.共役と超共役の違いは何ですか
– 主な相違点の比較
重要な用語:炭素、カルボカチオン、共役、水素、超共役、軌道、Pi 結合、P 軌道、シグマ結合

活用とは
共役とは、σ 結合 (シグマ結合) を横切る p 軌道の重なりです。シグマ結合は共有結合の一種です。二重結合を持つ不飽和化合物は、1 つのシグマ結合と 1 つのパイ結合で構成されます。これらの化合物の炭素原子は sp 混成です。ハイブリダイゼーションは sp であるため、各炭素原子ごとにハイブリダイズしていない p 軌道があります。化合物が単結合 (シグマ結合) と二重結合 (シグマ結合とパイ結合) を交互に持つ場合、ハイブリダイズしていない p 軌道が互いに重なり合い、電子雲を形成します。これらの p 軌道の電子は、この電子雲の中で非局在化します。この種の非局在化システムは、共役システムとして知られています。したがって、この p 軌道の重なりは共役として知られています。
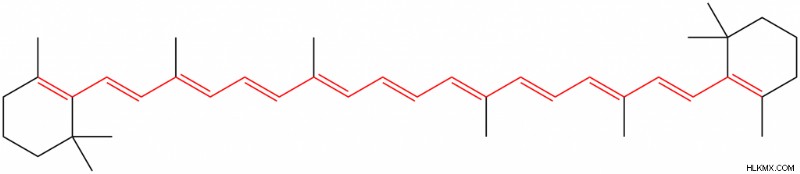
図 1:β-カロチン結合システム
シグマ結合は、2 つの原子軌道間の正面混合によって形成される強力な共有結合です。最も単純な共有結合は、2 つの原子の 2 つの s 軌道の間に形成されます。しかし、複雑な原子構造を持つ原子では、原子軌道がハイブリッド化(原子軌道が混ざり合って新しい形のハイブリッド軌道を形成すること)を起こします。 Sp ハイブリダイゼーションは、1 つの s 軌道と 2 つの p 軌道の間のハイブリダイゼーションです。原子には 3 つの p 軌道があるため、sp 混成の後、混成されていない p 軌道が残ります。化合物のすべての隣接する炭素原子がハイブリダイズしていない p 軌道を持っている場合、これらの軌道は互いに重なり合う可能性があります。これにより、共役システムが作成されます。
共役は環状化合物でもある芳香族化合物で観察できます。ベンゼンは共役π電子系を持つ芳香族化合物です。ベンゼン環は、sp ハイブリダイズした 6 つの炭素原子でできています。したがって、6 つの炭素原子はすべて、ハイブリダイズしていない p 軌道を持っています。これらの軌道は互いに重なり合い、共役系を形成します。
超共役とは
超共役とは、σ 結合と pi ネットワークとの相互作用です。ここで、シグマ結合の電子は、隣接する部分的 (または完全に) 満たされた p 軌道、または pi 軌道と相互作用します。超共役は、分子の安定性を高めるために発生します。
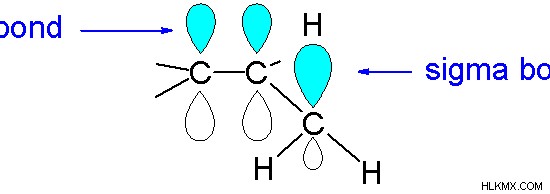
図 2:超共役は Pi 軌道とシグマ結合の間で発生する可能性があります
超共役は、隣接する炭素原子の p 軌道または pi 軌道との C-H シグマ結合の結合電子の重なりによって引き起こされます。水素原子は陽子として近接しています。炭素原子に発生する負電荷は、p 軌道または pi 軌道の重なりにより非局在化されます。
化合物の化学的性質に対する超共役の効果がいくつかあります。たとえば、カルボカチオンでは、超共役により炭素原子に正電荷が生じます。
共役と超共役の違い
定義
活用: 共役は、σ 結合 (シグマ結合) を横切る p 軌道の重なりです。
超共役: 超共役とは、σ 結合と pi ネットワークとの相互作用です。
関連するコンポーネント
活用: 共役は p 軌道間で発生します。
超共役: 超共役は、シグマ結合と p 軌道または pi 軌道の間で発生します。
発生
活用: 結合は、単結合と二重結合が交互にある化合物で発生します。
超共役: 超共役は、C-H 結合に隣接する p 軌道または pi 軌道を持つカルボカチオンまたはその他の化合物で発生します。
結果
活用: 共役は、非局在化した pi 電子雲をもたらします。
超共役: 超共役はプロトンと安定化分子をもたらします。
結論
共役と超共役という 2 つの用語は、不飽和有機化合物を表します。共役と超共役の主な違いは、共役が σ 結合を横切る p 軌道の重なりであるのに対し、超共役は σ 結合と pi ネットワークとの相互作用であることです。
参照:
1. Helmenstine、Anne Marie、Ph.D. 「化学における共役定義」。 ThoughtCo、2017 年 3 月 19 日、こちらから入手可能。
2.「共役系」。ウィキペディア、ウィキメディア財団、2018 年 1 月 26 日、こちらから入手可能。
3. Devyani Joshi、SRS Pharmaceuticals Pvt.株式会社、インド「超共役 - 有機化学」。 LinkedIn SlideShare、2016 年 11 月 10 日、こちらから入手可能。
画像提供:
1. Sirjasonrによる「ベータカロテン抱合」 – Commons Wikimedia経由の自身の作品(パブリックドメイン)
2. 英語版WikipediaのV8rikによる「HyperconjugationInSubstitutedAlkenes」(CC BY-SA 3.0)、Commons Wikimedia経由