これが故障です:
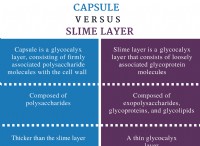
* イオン化合物: 塩化ナトリウムはイオン化合物であり、積極的に帯電したナトリウムイオン(Na+)と負に帯電した塩化物イオン(CL-)で構成されています。これらのイオンは、結晶格子構造の静電力によって結合されます。
* 極性溶媒: 水は極性溶媒です。つまり、水素原子に部分的な正電荷と酸素原子に部分的な負電荷があります。この極性により、水分子は塩化ナトリウムのイオンと相互作用することができます。
* 溶解: 塩化ナトリウムを水に加えると、極水分子がナトリウムと塩化物イオンを囲み、結晶格子のイオン結合を破壊します。水分子の正の端は、負の塩化物イオンに引き付けられ、水分子の負の端は正のナトリウムイオンに引き付けられます。このプロセスは水和と呼ばれます 。
* 解離: 水和プロセスが続くと、ナトリウムイオンと塩化物イオンの間のイオン結合が壊れ、イオンは溶液中に分離されます。このプロセスは解離と呼ばれます 。
全体的な反応は、として表すことができます
NaCl(s)→Na +(aq) + cl-(aq)
ここで:
* NaCl(s)は固体塩化ナトリウムを表します
* Na+(Aq)は、溶液中の水和ナトリウムイオンを表します
* Cl-(aq)は、溶液中の水塩化塩化物イオンを表します
重要な注意: 水中の塩化ナトリウムの溶解は物理的な変化です 、化学的変化ではありません。新しい物質は形成されていません。イオンは単に分離され、水分子に囲まれています。