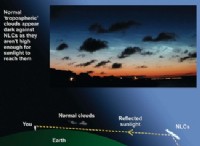
その理由は次のとおりです。
* ナトリウムは高度な電気依存症の要素です。 これは、最も外側の電子を容易に失い、正のイオン(Na+)を形成することを意味します。
* 水は極分子です。 それはわずかに正の末端(水素原子)とわずかに負の末端(酸素原子)を持っています。
* ナトリウムが水と接触すると、水分子に電子を容易に寄付します。 これにより、ナトリウムイオン(Na+)と水酸化物イオン(OH-)が作成されます。
* 反応はかなりの量の熱を放出します 、これも生成される水素ガスを点火するのに十分な場合があります。
反応は、次の方程式によって要約されています:
2 Na(s) + 2 H2O(L)→2 NaOH(aq) + H2(g) +熱
反応は非常に発熱性であり、多くの熱を放出します。この熱は、生成された水素ガスを発火させ、激しい爆発を引き起こす可能性があります。
安全上の注意事項:
* 適切な安全装置とトレーニングなしでナトリウム金属を処理しないでください。
* ナトリウム金属を水から遠ざけてください。
* 乾燥した不活性な雰囲気にナトリウム金属を貯蔵しています。
ナトリウム金属に遭遇した場合、資格のある専門家にすぐに連絡することが重要です。