1。極性:
*水は極性分子であり、つまり、わずかに正の末端(水素原子)とわずかに陰性の末端(酸素原子)があります。この不均一な電荷分布により、水は塩のような極性物質の優れた溶媒になります。
*多くの場合、イオン化合物で構成されるミネラルも、成分(陽イオンと陰イオン)を充電しています。
2。水素結合:
*水分子は互いに強い水素結合を形成します。これらの結合は、鉱物表面との相互作用にも重要です。
*水分子が鉱物表面と接触すると、表面上のイオンと水素結合を形成できます。これにより、ミネラルのイオン間の結合が弱まり、それらが溶解しやすくなります。
3。イオン双極子相互作用:
*水分子の正の端(水素)はミネラルの陰性イオン(陰イオン)に引き付けられ、水分子(酸素)の負の端は陽性イオン(陽イオン)に引き付けられます。
*これらの相互作用は、ミネラル内の結合をさらに弱め、溶液にイオンを放出します。
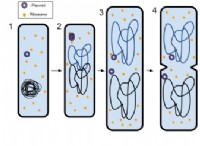
プロセス:
1。水分子は鉱物表面を囲みます。
2。水分子とイオン双極子の相互作用が水分子と鉱物イオンの間で発生します。
3。これらの相互作用は、鉱物構造内の結合を弱めます。
4。鉱物からのイオンが水に放出され、溶液が形成されます。
溶解に影響する要因:
* 鉱物タイプ: 異なる鉱物は、化学組成と結晶構造に基づいて溶解度が異なります。
* 水温: 高温が水分子の運動エネルギーを増加させ、より速い溶解につながります。
* 水ph: 水の酸性度またはアルカリ度は、特定の鉱物の溶解度に影響を与える可能性があります。
* 他のイオンの存在: 他の溶解イオンの存在は、競合相互作用のために特定の鉱物の溶解度に影響を与える可能性があります。
要約すると、水のユニークな極性、水素結合能力、およびイオンとの相互作用能力により、ミネラルを効果的に溶解し、構成要素に分解し、溶液に放出します。