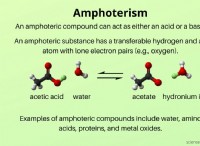
アルコール:
* 極: アルコール中のヒドロキシル基は、それらを極性分子にします。この極性により、水のような他の極性分子と水素結合を形成することができ、極地化合物に適した溶媒になります。
* 水素結合: ヒドロキシル基は、他のアルコール分子との水素結合を形成することができ、エーテルと比較して分子間力とより高い沸点をもたらします。
* プロティック溶媒: アルコールはプロティック溶媒です。つまり、他の分子にプロトン(H+)を寄付することができます。これにより、プロトンの伝達を伴う反応に適しています。
エーテル:
* 極性が少ない: エーテルはヒドロキシル基を欠いているため、アルコールよりも極性が低いです。それらはまだいくつかの極性分子を溶解することができますが、それらの溶解度は一般にアルコールよりも低くなっています。
* 分子間力が弱い: エーテルに水素結合がないことは、分子間力が弱くなり、アルコールと比較して沸点が低下します。
* estotic溶媒: エーテルは非難溶媒であり、陽子を寄付することはできません。それらはしばしば、陽子の伝達が望ましくない反応で使用されます。
主要な違いを要約するテーブルです:
|機能|アルコール|エーテル|
| ------------------ | ----------------------------- | ------------------------------------------------------------------------------------------------------------------------------------------------------------
|極性|より多くの極性|極性が低い|
|水素結合|存在|不在|
|沸点|より高い|低い|
|溶媒特性|極地化合物に適しています|非極性化合物に適しています|
|プロトイック/アプローチ|プロティック|アプローチ|
要約:
* アルコール 極性化合物の優れた溶媒であり、プロトン移動が必要な反応でよく使用されます。
* エーテル 非極性化合物の優れた溶媒であり、プロトンの伝達が望ましくない反応でしばしば使用されます。
例:
* エタノール(アルコール) 水、砂糖、塩に適した溶媒です。
* ジエチルエーテル 脂肪、油、およびその他の非極性物質に適した溶媒です。