1。 溶解におけるエネルギーの役割:
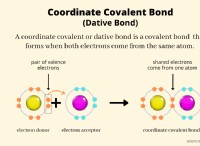
* 破壊債: 溶解は、溶質の粒子(塩のイオン結合など)と溶媒の粒子間の引力(水中の水素結合など)の間の引力を克服する必要があります。これにはエネルギーが必要です。
* 新しい結合の形成: 溶媒粒子が溶媒に分散すると、溶質粒子と溶媒粒子の間に新しい引力が形成されます(たとえば、塩イオンと水分子間のイオン双極子相互作用)。これはエネルギーを放出します。
2。 エネルギーのバランス:
* エンタルピー: 結合の破壊と形成に関連するエネルギー変化は、溶液のエンタルピー変化(ΔHsoln)と呼ばれます。陽性(吸熱、エネルギーが必要)または陰性(発熱、エネルギーを放出)になる可能性があります。
* エントロピー: 溶解には、エントロピー(障害)の増加も伴います。溶質粒子は溶媒内でより分散し、よりランダムなシステムになります。
* ギブス自由エネルギー: 溶解の自発性は、エンタルピーとエントロピーの両方を考慮するギブス自由エネルギー変化(ΔGSOLN)によって決定されます。
3。 温度の影響:
* 温度が高いということは、より多くのエネルギーを意味します: 温度を上げると、粒子により多くの運動エネルギーが得られ、既存の結合を破壊し、新しい結合の形成を促進する可能性が高まります。
* 発熱と吸熱: 溶解が発熱(エネルギーを放出)の場合、温度の上昇は溶解プロセスを支持します。吸熱(エネルギーが必要)の場合、エネルギー障壁を克服するには温度が上がる必要があります。
要約:
溶質と溶媒の粒子のエネルギーは、溶媒を直接溶解しません。それは、溶質粒子、溶媒粒子、および溶質粒子と溶媒粒子の間に新しい相互作用 *を形成することによって放出されるエネルギー *の間の引力 *を克服するために必要なエネルギー *です。これらのエネルギーの変化のバランスは、エントロピーの増加とともに、物質がどの程度溶解するかどうかを決定します。