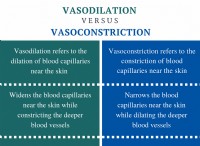
ただし、水分子は極性です - つまり、彼らはわずかに正の末端(水素原子の近く)とわずかに負の端(酸素原子の近く)を持っています。この極性は、水がNaClおよび他のイオン化合物を溶解できるようにするものです。
これがどのように機能しますか:
1。アトラクション: 水分子(水素)の正の端は、NaClの負に帯電した塩化物イオン(CL-)に引き付けられます。
2。周囲: 同様に、水分子(酸素)の負の端は、正に帯電したナトリウムイオン(Na+)に引き付けられます。
3。溶解: この魅力は、NaCl結晶格子のナトリウムイオンと塩化物イオンを一緒に保持するイオン結合を克服するのに十分な強さです。 水分子は個々のイオンを囲み、効果的にそれらを引き離し、溶液に分離します。
本質的に、水の極性により、NaClの荷電イオンの「磁石」のように作用し、結晶を溶解し、水和ナトリウムと塩化物イオンの溶液を作成することができます。