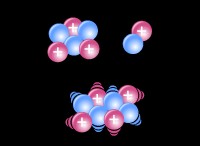
その理由は次のとおりです。
* 原子は再配置され、破壊されません: 化学反応では、関与する原子は単に再配置されて新しい分子を形成します。各要素の原子の総数は同じままです。
* 質量が保存されています: 各元素の原子の数は保存されているため、反応物の総質量(出発材料)は、生成物の総質量(形成された物質)に等しくなければなりません。
例:
水素ガス(H₂)と酸素ガス(O₂)の間の反応を考えて、水を形成します(H₂O)。
2h₂ +o₂→2h₂o
* 反応物: 2モルのh₂(2 x 2グラム=4グラム) + 1モルのo₂(32グラム)=36グラム
* 製品: 2モルのh₂o(2 x 18グラム=36グラム)
ご覧のとおり、反応物の質量(36グラム)は製品の質量(36グラム)に等しくなります。
重要な注意: この法律は、通常の化学反応に適用されます。核反応では、アインシュタインの有名な方程式E =MC²で説明されているように、少量の質量をエネルギーに変換できます。