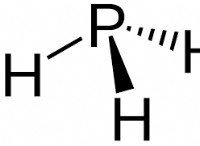
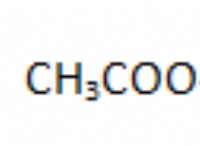ハロゲンが互いに反応すると、ハロゲン間化合物が形成されます。特定のハロゲンの中には、人間の体内で多数の調節的役割を果たしているものもあれば、基本的なものではないものもあります。ハロゲンは非金属である傾向があります。室温では、多くの場合、塩素とフッ素は蒸気であり、臭素は液体であり、アスタチンになるヨウ素は固体になる可能性があります.
ハロゲンは反応性があります。反応性はフッ素からアスタチンに低下します。ハロゲンは元素である自然のタイプには発生せず、アスタチン同位体は放射性であり、半減期は短い.
二元物質である可能性がある水素ソート化合物と反応するハロゲンのほとんどは、ハロゲン化水素と呼ばれます:フッ化水素 (HF)、塩化水素 (HCl)、臭化水素 (HBr)、ヨウ化水素 (HI)、およびアスタチド水素 (帽子)
HF を除いて、残りのハロゲンは強力な化学酸を形成します。しかし、フッ化水素酸は、人間を含む動物の組織に壊滅的な特性を持っています.
そのハロゲンの仲間を考慮すると、水素アスタチドは強酸 (静水酸) としても振る舞わなければなりません。しかし、それは穏やかな酸であり、腐食性のハロゲン化水素酸に数えられることを忘れがちです.
金属ハロゲン化物
金属ハロゲン化物は、ハロゲンと金属の間の化合物です。共有関係にあるものもあれば、イオン性のものもあります。共有結合した金属イオンは、ポリマーの骨格を形成する可能性があります。すべてのハロゲンが材料と反応すると、金属ハロゲン化物が生成されます。それは下の方程式で知られています。
2M + nX2 2MXn
塩化銀:硝酸銀の溶液を塩化物溶液に加えると、沈殿物が形成されます。
AgNO3(aq)+NaCl(aq)⟶AgCl(s)+NaNO3(aq)
ハロゲン化アルキル
ハロゲン化アルキル、RX、ここで R はアルキル基、X はハロゲン F、Cl、Br、または I)
ハロゲンが結合している親炭素に結合している炭素の数に応じて、1 次、2 次、3 次の 3 つのタイプに分類されます。

ハロゲン化アルキルを調製する一般的な反応は次のとおりです。
アルカン + ハロゲン (X) → ハロゲン化アルキル (R-X) + ハロゲン酸 (H-X)
この反応は、アルカンをハロゲン化アルキルに変換するとも言えます。
3 つの主な方法でハロゲン化アルキルを調製します。
<オール>C2H6 + Cl2 C2H5Cl + HCl
同様に、クロロメタン、クロロエタン、ブロモエタン、ブロモエタンなど、多くのハロゲン化アルキルが形成されます。
- 2 番目の方法は、ハロゲン化水素をアルケンに付加する方法です。例:

- 3 番目の方法は、アルカンのフリーラジカルハロゲン化です。例:
CH3CH2CH2CH3 Cl2/UV 光 HCl+ CH3CH2CH2CH2Cl
ビシナルジハライドは、炭素の両側にハロゲンがあり、ハロゲンとアルケンを反応させることによって調製されます。例:1,2-ジクロロエタン (二塩化エチレン)。
ハロゲン化アリール
ベンゼン環がハロゲンと反応すると、ハロゲン化アリールが形成されます。
以下は、いくつかのハロゲン化アリール反応です:

結論
ハロゲンは、周期表の第 17 族に属する元素であり、これらの元素は自然界に存在し、合成によって生成されます。ハロゲン化合物は、ハロゲン化水素、金属ハロゲン化物、ポリハロゲン化有機ハロゲン化合物、およびハロゲン化アルキル、ハロゲン化ビニル、およびハロゲン化アリールとして発生します。フッ素は最も有名なハロゲンで、反応性が最も高く、サイズが最小です。ハロゲン化合物の中で、最も無視され、最も放射性があるのはアスタチンで、塩素、臭素、ヨウ素が中間に位置します。
ハロゲン原子は親油性で、水に溶けにくい。ハロゲンは有機化学に限定されるものではなく、私たちの身の回りにあり、日常的に使用されています。