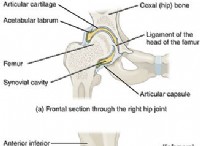
その理由は次のとおりです。
* イオン化合物: 塩(NaCl)はイオン化合物です。これは、正に帯電したイオン(陽イオン)と負に帯電したイオン(アニオン)の間の静電引力によって形成されることを意味します。塩の場合、これらはナトリウムイオン(Na+)および塩化物イオン(Cl-)です。
* 水への溶解: 塩が水に溶けると、水分子がイオンを囲み、それらを引き離します。このプロセスは水和と呼ばれます 。水分子は極性であり、それは正と負の端を持っていることを意味します。水分子の正の端は塩化物イオンを引き付け、負の端はナトリウムイオンを引き付けます。
* 導電率: イオンが分離されると、溶液中に自由に動き回ることができます。荷電粒子のこの動きは、溶液を電気的に導電性にするものです 、つまり、電流を運ぶことができます。
要約:
1。塩は、荷電イオンで構成されるイオン化合物です。
2。水に溶解すると、これらのイオンは分離してモバイルになります。
3.荷電粒子のこの移動度により、溶液が電気的に導電性であるため、電解質になります。