融点に影響する要因
* 分子間力: 分子間の分子間力(IMF)が強いほど、融点が高くなります。 これがIMFSの階層です:
* 水素結合: 最も強いIMFは、別の分子で孤立したペアと相互作用する高電気陰性原子(酸素、窒素、またはフッ素など)に結合した水素原子を含みます。
* 双極子型相互作用: 部分的な正電荷と負の電荷が引き付ける極性分子間で発生します。
* ロンドン分散部隊(LDF): 一時的な誘導双極子から生じるすべての分子に存在します。これらの力は、分子サイズと表面積の増加とともに増加します。
* 分子対称性: 対称的な分子は、固体状態でより効率的に梱包する傾向があり、より強い相互作用とより高い融点につながる傾向があります。
* 分子サイズと重量: より大きな分子には、より多くの電子とより大きな表面積があり、LDFSが強くなり、融点が高くなります。
官能基と融点
いくつかの一般的な機能グループが融点にどのように影響するかは次のとおりです。
* カルボン酸(-COOH): 強い水素結合を形成し、非常に高い融点をもたらします。
* アミン(-NH2): 水素結合を形成し、適度に高い融点をもたらすことができます。
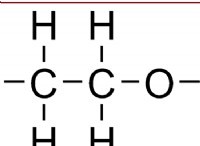
* アルコール(-oh): 水素結合を形成することができ、アルカンよりも高い融点を与えますが、一般にカルボン酸よりも低くなります。
* ケトン(c =o)およびアルデヒド(c =o): 双極子双極子の相互作用があり、その結果、適度に融点が高くなります。
* エーテル(-o-): 双極子双極子の相互作用はありますが、アルコールよりも極性が少なく、融点が低くなります。
* アルカン(-ch3、-ch2-): LDFのみがあり、リストされている機能グループの中で最も低い融点になります。
重要な考慮事項
* 全体的な分子構造: 融点に対する官能基の影響は、全体的な分子構造に大きく依存しています。たとえば、カルボン酸基を持つ小分子は、アルコール群を持つ大きな分子よりも融点が低い場合があります。
* 分岐: 分岐分子は、分子間相互作用の表面積が小さく、ストレートチェーンの対応物と比較して融点が低くなります。
例
* 酢酸(CH3COOH): 強い水素結合により、高い融点(16.6°C)があります。
* エタノール(CH3CH2OH): 水素結合により、適度に高い融点(-114°C)があります。
* ジエチルエーテル(CH3CH2OCH2CH3): 双極子双極子の相互作用が弱いため、融点が低い(-116°C)。
* ヘキサン(CH3(CH2)4CH3): LDFのみのため、非常に低い融点(-95°C)があります。
特定の官能基または分子を念頭に置いている場合はお知らせください。融点の挙動を分析するのに役立ちます!