1。化学を理解する
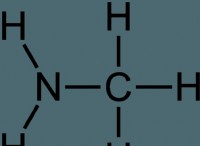
* 酢酸ナトリウム(Ch₃COONA) は、弱酸(酢酸、ch oh)の塩と強い塩基(水酸化ナトリウム、NaOH)です。
* 加水分解: 酢酸ナトリウムが水に溶解すると、加水分解します。つまり、アセテートイオン(Ch₃COO⁻)が水と反応して水酸化物イオン(OH⁻)と酢酸を生成します。
ch₃coo⁻ +h₂o
* 平衡: 溶液は、イオンの濃度と非関連酢酸が一定の平衡に達します。
2。 pHを使用してpoh を見つけます
* 関係: ph + poh =14
* poh:を計算します POH =14-9.05 =4.95
3。 [OH⁻]濃度を計算します
* pohと[oh⁻]: poh =-log [oh⁻]
* [oh⁻]:を解決します [OH⁻] =10⁻⁴⁹⁵=1.12 x10⁻⁵m
4。アイステーブルをセットアップ
| | ch₃coo⁻| ch₃cooh|ああ|
| ---------- | ---------- | ---------- | ---------- |
|初期| * c* | 0 | 0 |
|変更| - * x* | +* x* | +* x* |
|平衡| * c* - * x* | * x* | * x* |
どこ:
* * C *は酢酸ナトリウムの初期濃度です(見つけたいもの)
* * x *は濃度の変化であり、[oh⁻] =1.12x10⁻⁵mに等しいことがわかっています
5。酢酸のKaを使用してください
* ka: 酢酸の酸解離定数(Ch₃COOH)はKa =1.8x10⁻⁵です
6。平衡式を設定します
* ka式: ka =[ch₃cooh] [oh⁻] / [ch₃coo⁻]
* 代替品: 1.8 x10⁻⁵=(x)(x) /(c -x)
7。 C(初期濃度)を解く
*x *は *c *よりもはるかに小さいため、概算できます。
* c:c≈(x)² / 1.8 x10⁻⁵=(1.12 x10⁻⁵)² / 1.8 x10⁻⁵≈7.0x10⁻⁶mを解く
したがって、酢酸ナトリウム溶液のモル濃度は約7.0 x 10〜mです。